Nové publikácie
Identifikovaný proteín zodpovedný za genetické zápalové ochorenie
Posledná kontrola: 02.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Tím výskumníkov pod vedením Dr. Hirotsugu Odu z CECAD Cluster of Excellence for Aging Research na Univerzite v Kolíne nad Rýnom objavil úlohu, ktorú zohráva určitý proteínový komplex v niektorých formách imunitnej dysregulácie. Tento výsledok môže viesť k vývoju nových terapeutických prístupov zameraných na zníženie autoinflácie a „obnovenie“ imunitného systému pacientov trpiacich genetickou dysfunkciou tohto proteínového komplexu.
Štúdia s názvom „Strata funkcie bialelického ľudského SHARPINu indukuje autoinflamáciu a imunodeficienciu“ bola publikovaná v časopise Nature Immunology.
Lineárny ubikvitín-zostavujúci komplex (LUBAC), zložený z proteínov HOIP, HOIL-1 a SHARPIN, je už dlho uznávaný pre svoju kľúčovú úlohu pri udržiavaní imunitnej homeostázy. Predchádzajúce štúdie na myšiach preukázali závažné následky straty SHARPIN, ktoré viedli k závažnej dermatitíde v dôsledku nadmernej smrti kožných buniek. Konkrétne zdravotné následky nedostatku SHARPIN u ľudí však zostávajú nejasné.
Výskumný tím po prvýkrát informoval o dvoch ľuďoch s deficitom SHARPIN, ktorí vykazujú príznaky autoinflácie a imunodeficiencie, ale neočakávane nevykazujú dermatologické problémy ako u myší.
Pri ďalšom vyšetrení sa u týchto jedincov zistila zhoršená kanonická odpoveď NF-κB, čo je dôležitá dráha imunitnej odpovede. Mali tiež zvýšenú náchylnosť na bunkovú smrť vyvolanú členmi superrodiny faktora nekrózy nádorov (TNF). Liečba jedného pacienta s deficitom SHARPIN anti-TNF terapiou, ktorá špecificky inhibuje bunkovú smrť indukovanú TNF, viedla k úplnému vyriešeniu autoinflácie na bunkovej úrovni a v klinickej prezentácii.
Štúdia ukazuje, že nadmerná a nekontrolovaná bunková smrť zohráva kľúčovú úlohu v geneticky podmienených zápalových ochoreniach u ľudí. Odov tím zaradil deficit SHARPINu medzi nových členov skupiny geneticky podmienených zápalových ochorení u ľudí, ktoré navrhujú nazvať „vrodené chyby bunkovej smrti“.
Ochrana pred imunitnou dysreguláciou Štúdia sa začala v laboratóriu Dr. Dana Kastnera v Národných inštitútoch zdravia (NIH) v Spojených štátoch. Vedci tam mali možnosť pozorovať jedného pacienta s nevysvetliteľnými epizódami horúčky, artritídy, kolitídy a imunodeficiencie, ktoré sa začali v detstve.
Po získaní informovaného súhlasu vykonali u pacienta a jeho rodinných príslušníkov exómové sekvenovanie a zistili, že pacient má zničujúci genetický variant v géne SHARPIN, ktorý viedol k nedetekovateľným hladinám proteínu SHARPIN. Zistili tiež, že pacientove bunky vykazovali zvýšený sklon k odumieraniu v kultivovaných bunkách aj v biopsiách pacienta.
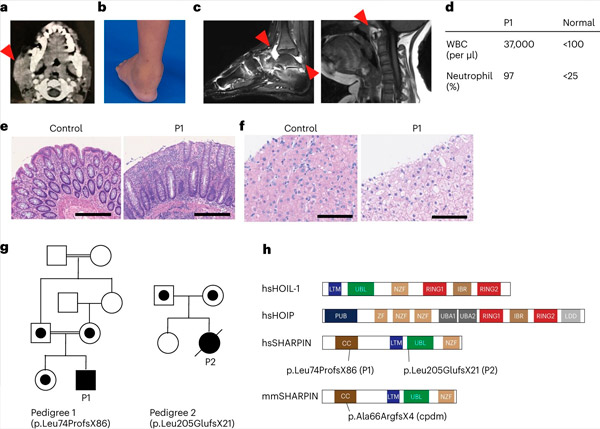
Nedostatok SHARPINu u ľudí spôsobuje autoimunitný zápal a glykogenózu pečene. Zdroj: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Tím tiež zistil, že vývoj lymfoidných germinálnych centier – špecializovaných mikroštruktúr v adenoidoch, ktoré sú kľúčové pre dozrievanie B buniek nášho imunitného systému, a teda pre produkciu protilátok – bol významne znížený v dôsledku zvýšeného úmrtia B buniek. Tieto zistenia vysvetľujú imunodeficienciu pacientov a zdôrazňujú dôležitú úlohu LUBAC pri udržiavaní imunitnej homeostázy u ľudí.
„Naša štúdia zdôrazňuje kľúčový význam LUBAC pri ochrane pred imunitnou dysreguláciou. Objasnením molekulárnych mechanizmov, ktoré sú základom nedostatku LUBAC, pripravujeme cestu pre nové terapeutické stratégie zamerané na obnovenie imunitnej homeostázy,“ povedal Oda, hlavný autor štúdie.
Dodal: „Jeden z pacientov s deficitom SHARPIN bol roky pripútaný na invalidný vozík, kým sme ho prvýkrát videli. Jeho členky boli zapálené a chôdza bola príliš bolestivá. Genetická diagnóza nám umožnila zamerať sa na správnu molekulárnu dráhu, ktorá je základom jeho ochorenia.“
Odkedy pacient začal dostávať anti-TNF liečbu, je už takmer sedem rokov bez príznakov. „Ako klinický lekár a vedec som rád, že mám možnosť pozitívne ovplyvniť život jedného pacienta prostredníctvom nášho výskumu,“ uzavrel Oda.
