Nové publikácie
Identifikovaný kľúčový proteín, ktorý zabraňuje úbytku kostnej hmoty pri osteoporóze
Posledná kontrola: 02.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
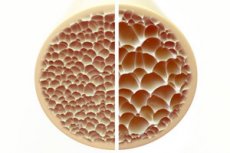
Osteoporóza, stav charakterizovaný pórovitými a krehkými kosťami, predstavuje významnú hrozbu pre zdravie kostry. Kosti ako primárna štrukturálna opora ľudského tela poskytujú životne dôležitú oporu. Keď sa kostná hmota zníži, nielenže sa táto opora zhorší, ale zhorší sa aj celková funkcia, čo vedie k zníženiu kvality života.
S rastúcim výskytom osteoporózy u starnúcej populácie sa zvyšuje záťaž na zdroje zdravotnej starostlivosti v oblasti dlhodobej starostlivosti. Preto je potrebné pochopiť mechanizmy, ktoré prispievajú k rozvoju osteoporózy, a vyvinúť účinné cielené liečebné postupy na minimalizáciu jej dlhodobého vplyvu.
Osteoblasty a osteoklasty sú dva typy buniek, ktoré hrajú kľúčovú úlohu v udržiavaní a prestavbe kostného tkaniva. Zatiaľ čo osteoblasty sú bunky tvoriace kosti zodpovedné za syntézu a ukladanie nového kostného tkaniva, osteoklasty sú bunky degradujúce kosti, ktoré sa podieľajú na rozklade a odstraňovaní starého alebo poškodeného kostného tkaniva.
Zvýšenie podielu osteoklastov vedie k úbytku kostnej hmoty pri ochoreniach, ako je osteoporóza, reumatoidná artritída (zápal kĺbov) a kostné metastázy (rakovina, ktorá sa rozšírila do kostí). Osteoklasty vznikajú diferenciáciou makrofágov alebo monocytov, čo sú typy imunitných buniek.
Inhibícia diferenciácie osteoklastov teda môže slúžiť ako terapeutická stratégia na prevenciu úbytku kostnej hmoty. Presné molekulárne mechanizmy regulujúce komplexný proces prestavby kostí však zostávajú nejasné.
V novej štúdii sa profesor Tadayoshi Hayata, pán Takuto Konno a pani Hitomi Murachi z Tokijskej univerzity vedy spolu s kolegami ponorili do molekulárnej regulácie diferenciácie osteoklastov. Stimulácia ligandom receptora aktivátora nukleárneho faktora kappa B (RANKL) indukuje diferenciáciu makrofágov na osteoklasty.
Okrem toho sa zistilo, že signálne dráhy kostného morfogenetického proteínu (BMP) a transformujúceho rastového faktora (TGF)-β sú zapojené do regulácie diferenciácie osteoklastov sprostredkovanej RANKL. V súčasnej štúdii sa výskumníci zamerali na skúmanie úlohy Ctdnep1, fosfatázy (enzýmu, ktorý odstraňuje fosfátové skupiny), o ktorej sa uvádza, že potláča signálne dráhy BMP a TGF-β.
Štúdia je publikovaná v časopise Biochemical and Biophysical Research Communications.
Profesor Hayata uvádza: „RANKL pôsobí ako „urýchľovač“ diferenciácie osteoklastov. Vedenie auta si vyžaduje nielen plynový pedál, ale aj brzdy. Tu sme zistili, že Ctdnep1 pôsobí ako „brzda“ pri diferenciácii osteoklastov.“
Výskumníci najprv skúmali expresiu Ctdnep1 v myších makrofágoch ošetrených RANKL a v neošetrených kontrolných bunkách. Zistili, že expresia Ctdnep1 sa v reakcii na stimuláciu RANKL nezmenila. V makrofágoch bol však lokalizovaný v cytoplazme v granulovanej forme a diferencovaný na osteoklasty, čo sa líši od jeho normálnej perinukleárnej lokalizácie v iných typoch buniek, čo naznačuje jeho cytoplazmatickú funkciu v diferenciácii osteoklastov.
Okrem toho, knockdown Ctdnep1 (zníženie regulácie génovej expresie) viedol k zvýšeniu počtu osteoklastov pozitívnych na tartrát-rezistentnú kyslú fosfatázu (TRAP), kde TRAP je markerom diferencovaných osteoklastov.
Vyradenie Ctdnep1 viedlo k zvýšenej expresii kľúčových diferenciačných markerov vrátane „Nfatc1“, hlavného transkripčného faktora indukovaného RANKL pre diferenciáciu osteoklastov. Tieto výsledky podporujú „brzdnú funkciu“ Ctdnep1, čím negatívne reguluje diferenciáciu osteoklastov. Okrem toho, vyradenie Ctdnep1 viedlo aj k zvýšenej absorpcii fosforečnanu vápenatého, čo naznačuje supresívnu úlohu Ctdnep1 v resorpcii kostí.
Nakoniec, hoci knockout Ctdnep1 nezmenil signalizáciu BMP a TGF-β, bunky s deficitom Ctdnep1 vykazovali zvýšené hladiny fosforylovaných (aktivovaných) proteínov, ktoré sú produktmi signálnej dráhy RANKL. Tieto výsledky naznačujú, že inhibičný účinok Ctdnep1 na diferenciáciu osteoklastov nemusí byť sprostredkovaný signalizáciou BMP a TGF-β, ale zníženou reguláciou signálnej dráhy RANKL a hladín proteínu Nfatc1.
Celkovo tieto výsledky poskytujú nové poznatky o procese diferenciácie osteoklastov a identifikujú potenciálne terapeutické ciele, ktoré by sa mohli použiť na vývoj liečby na zníženie úbytku kostnej hmoty v dôsledku nadmernej aktivity osteoklastov. Okrem ochorení charakterizovaných úbytkom kostnej hmoty bol Ctdnep1 identifikovaný aj ako kauzatívny faktor meduloblastómu, detského mozgového nádoru. Autori sú optimistickí, že ich výskum sa dá rozšíriť aj na ďalšie ľudské ochorenia nad rámec metabolizmu kostí.
Profesor Hayata uzatvára: „Naše výsledky naznačujú, že Ctdnep1 je potrebný na prevenciu nadmernej osteoklastogenézy. Tieto výsledky môžu ďalej rozšíriť naše poznatky o tom, ako fosforylačno-defosforylačná sieť riadi diferenciáciu osteoklastov, a môžu poskytnúť nové terapeutické stratégie na liečbu ochorení kostí spojených s nadmernou aktivitou osteoklastov.“
