Nové publikácie
Uzavretý systém podávania liekov by mohol zlepšiť podávanie chemoterapie
Posledná kontrola: 02.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Keď pacienti s rakovinou podstupujú chemoterapiu, dávky väčšiny liekov sa vypočítavajú na základe plochy povrchu tela pacienta. Táto plocha sa odhaduje pomocou rovnice, ktorá zohľadňuje výšku a hmotnosť pacienta. Táto rovnica bola formulovaná v roku 1916 na základe údajov od iba deviatich pacientov.
Tento zjednodušený prístup k dávkovaniu nezohľadňuje iné faktory a môže viesť k tomu, že pacientovi sa podá priveľa alebo primálo lieku. V dôsledku toho sa u niektorých pacientov môže prejaviť zbytočná toxicita alebo nedostatočná účinnosť chemoterapie, ktorú dostávajú.
Aby sa zlepšila presnosť dávkovania chemoterapie, inžinieri z MIT vyvinuli alternatívny prístup, ktorý umožňuje personalizáciu dávky pre každého pacienta. Ich systém meria množstvo lieku v tele pacienta a tieto údaje prenáša do ovládača, ktorý dokáže podľa toho upraviť rýchlosť infúzie.
Vedci tvrdia, že tento prístup by mohol pomôcť kompenzovať rozdiely vo farmakokinetike liekov spôsobené zložením tela, genetickou predispozíciou, orgánovou toxicitou vyvolanou chemoterapiou, interakciami s inými liekmi a potravinami a cirkadiánnymi variáciami enzýmov zodpovedných za rozklad chemoterapeutických liekov.
„Uznaním pokrokov v chápaní metabolizmu liekov a použitím inžinierskych nástrojov na zjednodušenie personalizovaného dávkovania veríme, že môžeme pomôcť transformovať bezpečnosť a účinnosť mnohých liekov,“ povedal Giovanni Traverso, docent strojárstva na MIT, gastroenterológ v nemocnici Brigham and Women's Hospital a hlavný autor štúdie.
Louis DeRidder, doktorand na MIT, je hlavným autorom článku publikovaného v časopise Med.
Nepretržité monitorovanie
V tejto štúdii sa výskumníci zamerali na liek s názvom 5-fluóruracil, ktorý sa používa na liečbu kolorektálneho karcinómu a iných druhov rakoviny. Liek sa zvyčajne podáva počas 46 hodín a jeho dávkovanie sa určuje pomocou vzorca založeného na výške a hmotnosti pacienta, ktorý poskytuje odhad plochy povrchu tela.
Tento prístup však nezohľadňuje rozdiely v zložení tela, ktoré môžu ovplyvniť spôsob, akým sa liek v tele distribuuje, ani genetické variácie, ktoré ovplyvňujú spôsob jeho metabolizácie. Tieto rozdiely môžu viesť k škodlivým vedľajším účinkom, ak sa podá priveľa lieku. Ak sa nepodá dostatok lieku, nemusí nádor zabiť podľa očakávania.
„Ľudia s rovnakou plochou povrchu tela môžu mať veľmi odlišnú výšku a hmotnosť, odlišnú svalovú hmotu alebo odlišnú genetiku, ale pokiaľ výška a hmotnosť zahrnuté do tejto rovnice vedú k rovnakej ploche povrchu tela, ich dávka je rovnaká,“ hovorí DeRidder, doktorand v programe medicínskeho inžinierstva a medicínskej fyziky na Harvard-MIT Program in Health Sciences and Technology.
Ďalším faktorom, ktorý môže kedykoľvek zmeniť množstvo lieku v krvi, je cirkadiánna variácia enzýmu nazývaného dihydropyrimidíndehydrogenáza (DPD), ktorý rozkladá 5-fluóruracil. Expresia DPD, podobne ako mnoho iných enzýmov v tele, je regulovaná cirkadiánnym rytmom. Degradácia 5-FU pomocou DPD teda nie je konštantná, ale mení sa v závislosti od dennej doby. Tieto cirkadiánne rytmy môžu viesť k desaťnásobnej zmene množstva 5-FU v krvi pacienta počas infúzie.
„Použitím plochy povrchu tela na výpočet dávky chemoterapie vieme, že dvaja ľudia môžu mať veľmi odlišné toxicity 5-fluóruracilu. Jeden pacient môže mať liečebné cykly s minimálnou toxicitou a potom cyklus s hroznou toxicitou. Niečo sa zmenilo v spôsobe, akým pacient metabolizoval chemoterapiu z jedného cyklu do druhého. Naša zastaraná metóda dávkovania tieto zmeny nezachytáva a pacienti v dôsledku toho trpia,“ hovorí Douglas Rubinson, klinický onkológ v Dana-Farber Cancer Institute a autor článku.
Jedným zo spôsobov, ako sa pokúsiť kompenzovať variabilitu vo farmakokinetike chemoterapie, je stratégia nazývaná terapeutické monitorovanie liečiv, pri ktorej pacient na konci jedného liečebného cyklu odoberie vzorku krvi. Po analýze tejto vzorky na koncentrácie liečiva je možné dávkovanie v prípade potreby upraviť na začiatku ďalšieho cyklu (zvyčajne po dvoch týždňoch v prípade 5-fluóruracilu).
Ukázalo sa, že tento prístup vedie k lepším výsledkom pre pacientov, ale nebol široko používaný pri chemoterapiách, ako je 5-fluóruracil.
Výskumníci z MIT chceli vyvinúť podobný typ monitorovania, ale automatizovaným spôsobom, ktorý by umožňoval personalizáciu dávkovania liekov v reálnom čase, čo by mohlo viesť k lepším výsledkom pre pacientov.
V ich uzavretom systéme je možné koncentrácie liečiv kontinuálne monitorovať a tieto informácie sa používajú na automatické nastavenie rýchlosti infúzie chemoterapeutického lieku, aby sa dávka udržala v cieľovom rozmedzí.
Tento systém s uzavretou slučkou umožňuje personalizáciu dávkovania liekov s ohľadom na cirkadiánne rytmy hladín enzýmov metabolizujúcich lieky, ako aj na akékoľvek zmeny vo farmakokinetike pacienta od poslednej liečby, ako napríklad chemoterapiou vyvolanú orgánovú toxicitu.
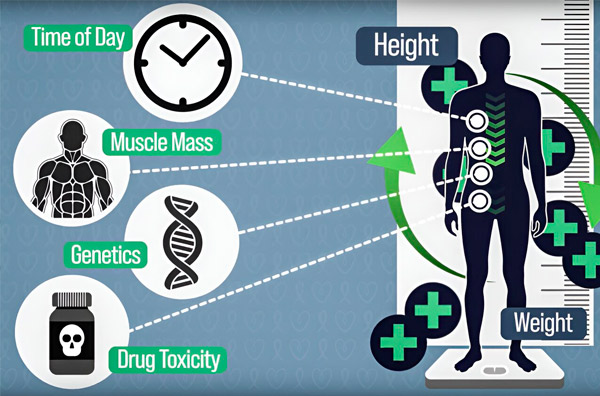
Aby bolo dávkovanie chemoterapie presnejšie, inžinieri z MIT vyvinuli spôsob, ako kontinuálne merať množstvo lieku v tele pacienta počas niekoľkohodinovej infúzie. To pomôže kompenzovať rozdiely spôsobené zložením tela, genetikou, toxicitou liekov a cirkadiánnymi osciláciami. Zdroj: S láskavým dovolením výskumníkov.
Nový systém vyvinutý výskumníkmi, známy ako CLAUDIA (Closed-Loop AUTOmated Drug Infusion regulAtor), využíva pre každý krok komerčne dostupné zariadenie. Vzorky krvi sa odoberajú každých päť minút a rýchlo sa pripravia na analýzu. Meria sa koncentrácia 5-fluóruracilu v krvi a porovnáva sa s cieľovým rozmedzím.
Rozdiel medzi cieľovou a nameranou koncentráciou sa zadáva do riadiaceho algoritmu, ktorý potom podľa potreby upravuje rýchlosť infúzie tak, aby sa dávka udržala v rozsahu koncentrácií, pri ktorých je liek účinný a netoxický.
„Vyvinuli sme systém, v ktorom môžeme kontinuálne merať koncentráciu lieku a podľa toho upravovať rýchlosť infúzie, aby sme udržali koncentráciu lieku v terapeutickom okne,“ hovorí DeRidder.
Rýchle nastavenie
V testoch na zvieratách výskumníci zistili, že pomocou lieku CLAUDIA dokázali udržať množstvo lieku cirkulujúceho v tele v cieľovom rozmedzí približne 45 percent času.
Hladiny liečiva u zvierat, ktorým bola podávaná chemoterapia bez lieku CLAUDIA, zostali v cieľovom rozmedzí v priemere iba v 13 percentách prípadov. Výskumníci v tejto štúdii netestovali účinnosť hladín liečiva, ale predpokladá sa, že udržiavanie koncentrácií v cieľovom rozmedzí vedie k lepším výsledkom a menšej toxicite.
Liek CLAUDIA dokázal udržať dávku 5-fluóruracilu v cieľovom rozmedzí aj pri podávaní lieku, ktorý inhibuje enzým DPD. U zvierat, ktorým bol tento inhibítor podávaný bez neustáleho monitorovania a úpravy dávky, sa hladiny 5-fluóruracilu zvýšili až osemnásobne.
Pre túto demonštráciu výskumníci manuálne vykonali každý krok procesu pomocou bežne dostupného vybavenia, ale teraz plánujú každý krok automatizovať, aby sa monitorovanie a úprava dávky mohli vykonávať bez ľudského zásahu.
Na meranie koncentrácií liečiv výskumníci použili vysokoúčinnú kvapalinovú chromatografiu s hmotnostnou spektrometriou (HPLC-MS), čo je technika, ktorú možno prispôsobiť na detekciu takmer akéhokoľvek typu liečiva.
„Vidíme budúcnosť, v ktorej môžeme použiť CLAUDIA pre akýkoľvek liek, ktorý má vhodné farmakokinetické vlastnosti a je detekovateľný pomocou HPLC-MS, čo umožňuje personalizované dávkovanie mnohých rôznych liekov,“ hovorí DeRidder.
