Vedci sledujú najskoršie fyzické zmeny v bunkách, ktoré spôsobujú rakovinu
Posledná kontrola: 14.06.2024

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Keď je diagnostikovaná rakovina, je za tým už veľa udalostí na bunkovej a molekulárnej úrovni, ktoré sa odohrali bez povšimnutia. Hoci sa rakovina na klinické účely delí na skoré a neskoré štádiá, dokonca aj „skoré“ štádium nádoru je výsledkom mnohých predchádzajúcich zmien v tele, ktoré boli nedetekovateľné.
Vedci z Yale University School of Medicine (YSM) a ich kolegovia teraz podrobne porozumeli niektorým z týchto skorých zmien pomocou výkonnej mikroskopie s vysokým rozlíšením na sledovanie úplne prvých fyzických zmien, ktoré spôsobujú rakovinu v bunkách kože myší..
Štúdiom myší, ktoré sú nositeľmi mutácie, ktorá podporuje rozvoj rakoviny vo vlasových folikuloch, vedci zistili, že prvé príznaky vzniku rakoviny sa vyskytujú v určitom čase a na určitom mieste v raste vlasových folikulov myší. Navyše zistili, že tieto prekancerózne zmeny možno blokovať liekmi známymi ako inhibítory MEK.
Tím viedol Tianchi Xin, Ph.D., postdoktorand na oddelení genetiky YSM, a zahŕňala Valentinu Greco, Ph.D., profesorku genetiky YSM a členku Yale Cancer Center a Yale Stem Cell Center a Sergi Regot, Ph.D., odborný asistent molekulárnej biológie a genetiky na Johns Hopkins School of Medicine.
Výsledky ich výskumu boli publikované v časopise Nature Cell Biology.
Vedci skúmali myši, u ktorých sa vyvinul spinocelulárny karcinóm kože, čo je druhý najčastejší typ rakoviny kože u ľudí. Tieto myši boli geneticky upravené tak, aby mali rakovinu podporujúcu mutáciu v géne KRAS, ktorý je jedným z najčastejšie mutovaných onkogénov v ľudských rakovinách. Mutácie KRAS sa našli aj pri rakovine pľúc, pankreasu a kolorektálneho karcinómu.
Skoré zmeny, ktoré vedci skúmali, zahŕňali rast malého, abnormálneho hrbolčeka vo vlasovom folikule, ktorý je klasifikovaný ako prekancerózna abnormalita. "Pochopenie týchto skorých udalostí nám môže pomôcť vyvinúť prístupy na prevenciu pred vznikom rakoviny," povedal Xin, prvý autor štúdie.
Aj keď sa ich štúdia zamerala na rakovinu kože, vedci sa domnievajú, že princípy, ktoré objavili, by sa dali použiť na mnohé iné druhy rakoviny spôsobené mutáciami KRAS, pretože kľúčové gény a proteíny, ktoré sa podieľajú na rôznych nádoroch, sú rovnaké.
Viac než len bunková proliferácia Vlasové folikuly u ľudí aj myší neustále rastú, vypadávajú staré vlasy a tvoria sa nové. Veľkú úlohu v tomto procese obnovy zohrávajú kmeňové bunky, ktoré majú schopnosť vyvinúť sa na rôzne typy buniek. Predchádzajúce štúdie ukázali, že mutácie KRAS vedú k zvýšenej proliferácii kmeňových buniek vo vlasových folikuloch a tento významný nárast počtu kmeňových buniek sa považoval za zodpovedný za prekanceróznu léziu tkaniva.
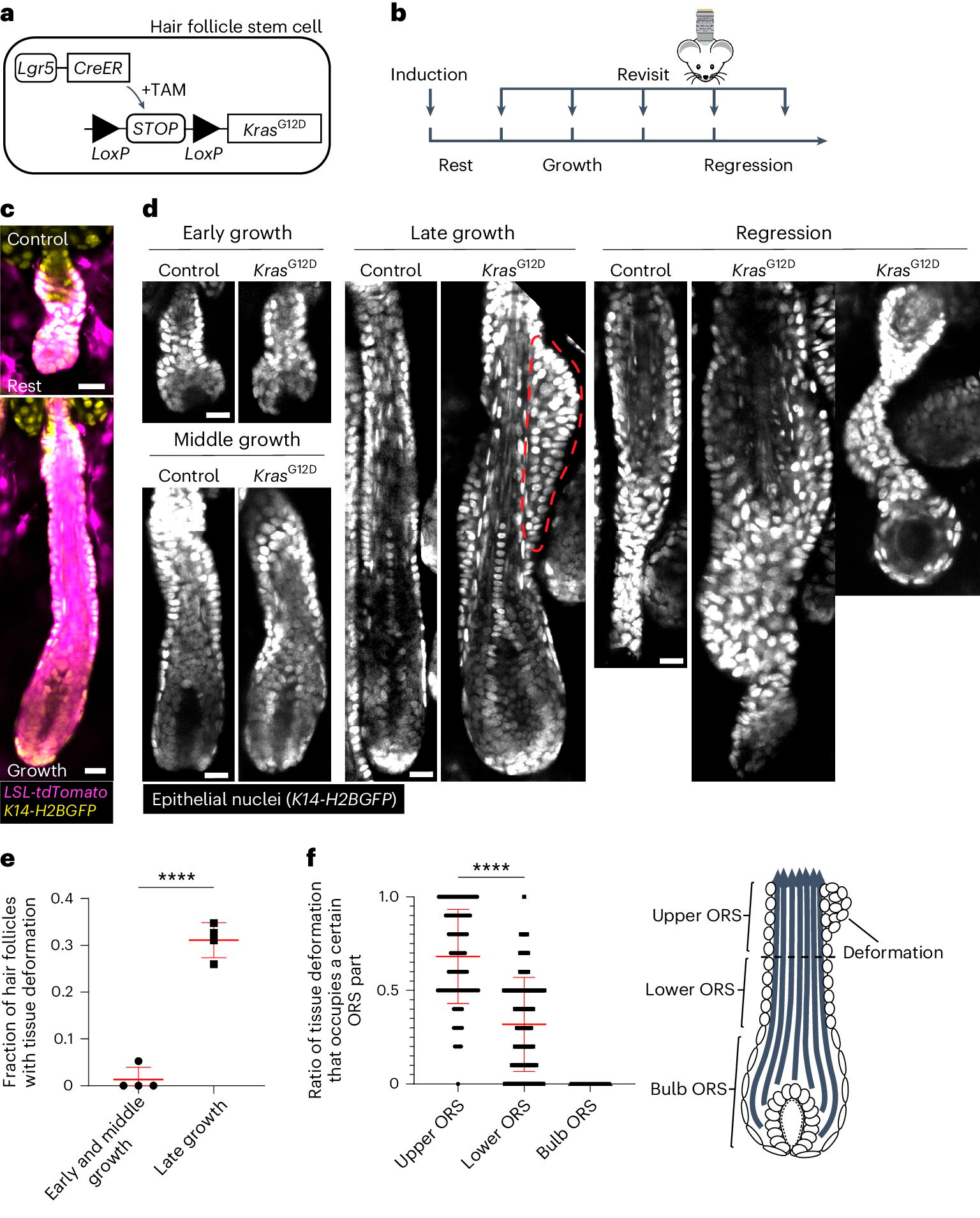
KrasG12D spôsobuje časopriestorové špecifické deformácie tkaniva počas regenerácie vlasových folikulov.
a. Schéma genetického prístupu k indukcii KrasG12D v kmeňových bunkách vlasových folikulov pomocou tamoxifénom indukovateľného Cre–LoxP (TAM) systému.
b. Diagram zobrazujúci načasovanie indukcie a opätovného zobrazenia KrasG12D vo vzťahu k štádiám cyklu rastu vlasov.
c. Reprezentatívne snímky divokého typu odpočívajúcich a rastúcich vlasových folikulov obsahujúcich Cre tdTomato (Magenta) indukovateľný reportér po indukcii.
d. Reprezentatívne obrázky kontrolných a vlasových folikulov KrasG12D v rôznych fázach cyklu rastu vlasov. Deformácia tkaniva vo forme tuberkul vo vonkajšom koreňovom obale (ORS) je označená červenou bodkovanou čiarou.
e. Podiel vlasových folikulov KrasG12D s deformáciou tkaniva v rôznych štádiách rastu vlasových folikulov.
f. Podiel deformácií tkaniva, ktoré zaberajú hornú, dolnú a cibuľovú časť ORS pre jednotlivé vlasové folikuly KrasG12D.
Zdroj: Nature Cell Biology (2024). DOI: 10.1038/s41556-024-01413-y
Na otestovanie tejto hypotézy tím použil špeciálne navrhnutú formu mutovaného KRAS, ktorý by mohli aktivovať v špecifických časoch v kožných bunkách vlasových folikulov zvierat. Xin a jeho kolegovia použili mikroskopickú techniku známu ako intravitálne zobrazovanie, ktorá umožňuje snímky buniek v živom tele s vysokým rozlíšením a označovať a sledovať jednotlivé kmeňové bunky u zvierat.
Keď bola aktivovaná mutácia KRAS, všetky kmeňové bunky sa začali množiť rýchlejšie, ale prekancerózny hrbolček sa vytvoril iba na jednom konkrétnom mieste vo vlasovom folikule a v jednom štádiu rastu, čo znamená, že celkový nárast počtu buniek pravdepodobne nebol nie celý príbeh.
Aktivácia mutácie KRAS vo vlasových folikuloch viedla k rýchlejšej proliferácii kmeňových buniek, zmene ich migračných vzorcov a deleniu v rôznych smeroch v porovnaní s bunkami bez mutácie podporujúcej rakovinu.
Mutácia ovplyvňuje proteín známy ako ERK. Xin dokázal pozorovať aktivitu ERK v reálnom čase v jednotlivých kmeňových bunkách u živých zvierat a objavil špecifickú zmenu aktivity tohto proteínu spôsobenú mutáciou KRAS. Výskumníkom sa tiež podarilo zastaviť tvorbu prekancerózneho hrbolčeka pomocou inhibítora MEK, ktorý blokuje aktivitu ERK.
Liek zastavil účinky mutácie na migráciu a orientáciu buniek, ale nie na celkovú proliferáciu kmeňových buniek, čo znamená, že vznik prekancerózneho stavu je spôsobený týmito prvými dvoma zmenami a nie zvýšenou proliferáciou buniek.
Prekancerózne zmeny v kontexte Sledovanie účinkov onkogénnej mutácie v reálnom čase v živom organizme je jediný spôsob, ako vedci dokázali objaviť tieto princípy. Je to dôležité, pretože rakovina nevzniká vo vákuu – jej rast a udržiavanie je veľmi závislé od jej mikroprostredia. Vedci tiež potrebovali sledovať nielen správanie jednotlivých buniek, ale aj molekúl v týchto bunkách.
"Prístup, ktorý sme zvolili k pochopeniu týchto onkogénnych udalostí, je skutočne o prepojení naprieč škálami," povedal Greco. „Rámec a prístupy, ktoré Dr. Xin použil v spolupráci s Dr. Regotom, nám umožnili prejsť nadol k molekulárnym prvkom, prepojiť ich s bunkovou a tkanivovou mierkou, čo nám dáva riešenie týchto udalostí, ktoré je tak ťažké dosiahnuť vonku. Živý organizmus."
Výskumníci chcú teraz sledovať proces počas dlhšieho časového obdobia, aby zistili, čo sa stane po vytvorení počiatočného nárazu. Chcú tiež študovať ďalšie onkogénne javy, ako je zápal, aby zistili, či princípy, ktoré objavili, platia aj v iných kontextoch.
