Mutácia génu ARID1A robí nádory citlivými na imunoterapiu
Posledná kontrola: 14.06.2024

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Imunoterapia spôsobila v posledných rokoch revolúciu v liečbe rakoviny. Namiesto priameho zacielenia na nádory, imunoterapia nasmeruje imunitný systém pacientov k účinnejšiemu napadnutiu nádorov. To je obzvlášť účinné pri niektorých ťažko liečiteľných rakovinách. Menej ako polovica všetkých pacientov s rakovinou však reaguje na súčasné imunoterapie, čo vytvára naliehavú potrebu identifikovať biomarkery, ktoré dokážu predpovedať, ktorí pacienti budú mať z liečby najväčší úžitok.
Vedci si nedávno všimli, že pacienti, ktorých nádory majú génovú mutáciu ARID1A, s väčšou pravdepodobnosťou reagujú pozitívne na blokádu imunitného kontrolného bodu, čo je typ imunoterapie, ktorý funguje. Udržiavanie aktivovaných imunitných buniek bojujúcich proti rakovine.
Keďže mutácia génu ARID1A je prítomná pri mnohých druhoch rakoviny, vrátane rakoviny endometria, vaječníkov, hrubého čreva a konečníka, žalúdka, pečene a pankreasu, vedci z inštitútu Salk sa pýtali, ako by mohla prispieť k citlivosti na liečbu a ako môžu lekári použiť tieto informácie na personalizáciu rakoviny. Liečby pre každého pacienta.
Ich nová štúdia publikovaná v journal Cell ukazuje, že mutácia ARID1A robí nádory citlivými na imunoterapiu náborom imunitných buniek bojujúcich proti rakovine do nádoru prostredníctvom imunitnej odpovede. Podobne ako antivírusové.
Výskumníci naznačujú, že táto mutácia a antivírusová imunitná odpoveď by sa mohli použiť ako biomarker na lepší výber pacientov na špecifické imunoterapie, ako je blokáda kontrolných bodov imunity. Tieto výsledky tiež podporujú vývoj liekov, ktoré sa zameriavajú na ARID1A a jeho pridružené proteíny, aby boli iné nádory citlivejšie na imunoterapiu.
„To by mohlo skutočne zmeniť výsledok liečby rakoviny u pacientov,“ hovorí docentka Diana Hargreavesová, hlavná autorka štúdie. "Pacienti s mutáciou ARID1A už majú imunitnú odpoveď, takže všetko, čo musíme urobiť, je posilniť túto odpoveď blokádou kontrolných bodov imunity, ktorá im pomôže zničiť ich nádory zvnútra."
Aj keď bolo známe, že ľudia s mutáciami ARID1A dobre reagujú na blokádu imunitného kontrolného bodu, presný vzťah medzi nimi zostal nejasný. Na objasnenie mechanizmu tohto procesu vedci zo Salkovho inštitútu použili myšacie modely melanómu a kolorektálneho karcinómu s mutáciou ARID1A a funkčným ARID1A.
Zdroj: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Tím pozoroval silnú imunitnú odpoveď vo všetkých modeloch s mutáciou ARID1A, ale nie v tých, kde bola ARID1A funkčná, čo podporuje myšlienku, že mutácia ARID1A skutočne riadi túto odpoveď. Ale ako to funguje na molekulárnej úrovni?
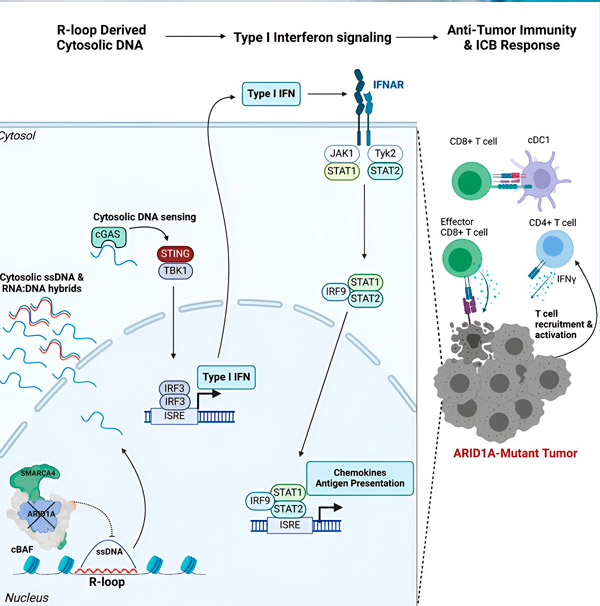
„Zistili sme, že ARID1A hrá dôležitú úlohu v jadre udržiavaním správnej organizácie DNA,“ hovorí Matthew Maxwell, prvý autor štúdie a postgraduálny študent v laboratóriu Hargreaves. "Bez funkčného ARID1A môže byť voľná DNA vyrezaná a uvoľnená do cytosólu, čo aktivuje požadovanú antivírusovú imunitnú odpoveď, ktorá môže byť posilnená blokádou imunitného kontrolného bodu."
Gén ARID1A kóduje proteín, ktorý pomáha regulovať tvar našej DNA a udržiavať stabilitu genómu. Keď ARID1A zmutuje, v rakovinových bunkách sa spustí reťazec udalostí podobných stroju Rube Goldberga.
Na začiatku neprítomnosť funkčného ARID1A vedie k uvoľneniu DNA do cytosólu. Cytosolická DNA potom aktivuje antivírusový poplašný systém, dráhu cGAS-STING, pretože naše bunky sú prispôsobené na označenie akejkoľvek DNA v cytosóle ako cudzorodej na ochranu pred vírusovými infekciami. V konečnom dôsledku dráha cGAS-STING získava imunitný systém na získavanie T buniek do nádoru a aktivuje ich na špecializované T bunky zabíjajúce rakovinu.
V každom kroku, v závislosti od predchádzajúceho, tento reťazec udalostí – mutácia ARID1A, únik DNA, výstraha cGAS-STING, nábor T buniek – vedie k zvýšeniu počtu T buniek bojujúcich proti rakovine v nádore. Blokáda imunitného kontrolného bodu sa potom môže použiť na zabezpečenie toho, aby tieto T bunky zostali aktivované, čím sa zvýši ich schopnosť poraziť rakovinu.
"Naše zistenia poskytujú nový molekulárny mechanizmus, ktorým môže mutácia ARID1A prispieť k protinádorovej imunitnej odpovedi," hovorí Hargreaves. "Najvzrušujúcejšia vec na týchto výsledkoch je ich translačný potenciál. Mutácie ARID1A môžeme použiť na výber pacientov na blokádu kontrolných bodov imunity a teraz vidíme mechanizmus, pomocou ktorého by sa lieky, ktoré inhibujú ARID1A alebo jeho proteínový komplex, mohli použiť na ďalšie posilnenie imunoterapie." u iných pacientov.“
Popísaním mechanizmu, ktorým je blokáda imunitného kontrolného bodu účinnejšia pri rakovine s mutáciou ARID1A, výskumníci poskytujú klinickým lekárom zdôvodnenie, aby uprednostnili túto imunoterapiu pre pacientov s mutáciou ARID1A. Tieto výsledky predstavujú dôležitý krok pri personalizácii liečby rakoviny a inšpirujú vývoj nových terapií zameraných na inhibíciu ARID1A a jeho proteínového komplexu.
V budúcnosti tím Salk Institute dúfa, že ich zistenia zlepšia výsledky u pacientov s rôznymi typmi rakoviny spojenými s mutáciami ARID1A, a má v úmysle preskúmať tento klinický preklad v spolupráci s Kalifornskou univerzitou v San Diegu.
p>
