Nové publikácie
Nové genetické mechanizmy by mohli byť terapeutickým cieľom proti gliómu
Posledná kontrola: 02.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Štúdia z laboratória Shi-Yuan Cheng, PhD, profesora na Neuroonkologickej divízii Kena a Ruth Daveyovcov na Neurologickej klinike, identifikovala nové mechanizmy, ktoré sú základom alternatívnych udalostí zostrihu RNA v nádorových bunkách gliómu, ktoré môžu slúžiť ako nové terapeutické ciele. Výsledky štúdie sú publikované v časopise Journal of Clinical Investigation.
„Našli sme iný spôsob liečby gliómu prostredníctvom optiky alternatívneho zostrihu a objavili sme nové ciele, ktoré predtým neboli identifikované, ale sú dôležité pre malignitu gliómu,“ povedal Xiao Song, MD, PhD, docent neurológie a hlavný autor štúdie.
Gliómy sú najčastejším typom primárneho nádoru mozgu u dospelých a pochádzajú z gliových buniek, ktoré sa nachádzajú v centrálnom nervovom systéme a podporujú susedné neuróny. Gliómy sú vysoko rezistentné na štandardnú liečbu vrátane ožarovania a chemoterapie kvôli genetickej a epigenetickej heterogenite nádoru, čo zdôrazňuje potrebu nájsť nové terapeutické ciele.
Predchádzajúci výskum z laboratória Cheng, publikovaný v časopise Cancer Research, ukázal, že dôležitý splicingový faktor SRSF3 je v gliómoch významne zvýšený v porovnaní s normálnymi mozgami a splicing RNA regulovaný SRSF3 podporuje rast a progresiu gliómu ovplyvňovaním viacerých bunkových procesov v nádorových bunkách.
Zostrih RNA je proces, ktorý zahŕňa odstránenie intrónov (nekódujúcich oblastí RNA) a spojenie exónov (kódujúcich oblastí) za vzniku zrelej molekuly mRNA, ktorá podporuje génovú expresiu v bunke.
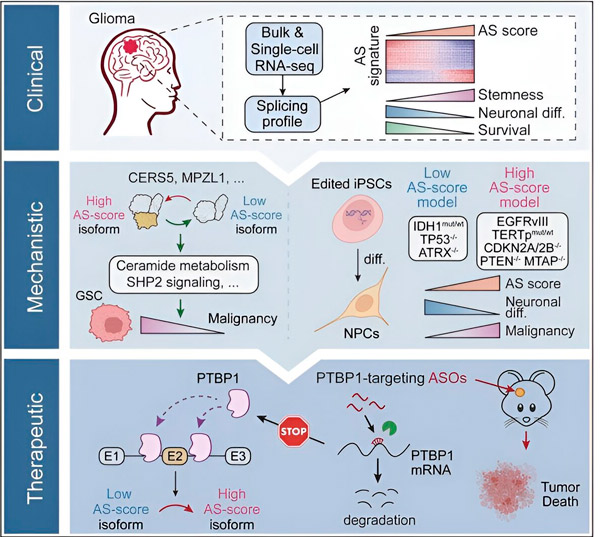
V tejto štúdii sa vedci zamerali na identifikáciu zmien v alternatívnom zostrihu v nádorových bunkách gliómu, mechanizmov, ktoré sú základom týchto zmien, a určenie ich potenciálu ako terapeutických cieľov.
Pomocou výpočtových metód a technológií sekvenovania RNA výskumníci skúmali zmeny zostrihu v nádorových bunkách gliómu zo vzoriek pacientov. Na potvrdenie týchto zmien použili technológie génovej úpravy CRISPR na zavedenie rôznych mutácií gliómových hnacích faktorov do modelov gliómu odvodených z ľudských indukovaných pluripotentných kmeňových buniek (iPSC).
Zistili, že tieto zmeny zostrihu sú zosilnené variantom receptora epidermálneho rastového faktora III (EGFRIII), o ktorom je známe, že je nadmerne exprimovaný v mnohých nádoroch vrátane gliómov, a sú inhibované mutáciou v géne IDH1.
Výskumníci potvrdili funkciu dvoch udalostí zostrihu RNA, ktoré vytvárajú rôzne izoformy proteínov s rôznymi aminokyselinovými sekvenciami.
„Len jedna z týchto izoforiem môže podporovať rast nádoru, na rozdiel od druhej izoformy, ktorá sa normálne exprimuje v normálnom mozgu. Nádory využívajú tento mechanizmus na selektívnu expresiu izoformy podporujúcej nádor oproti izoforme normálneho mozgu,“ povedal Song.
Tím potom analyzoval upstreamové proteíny viažuce RNA a zistil, že gén PTBP1 reguluje zostrih RNA podporujúci nádor v gliómových bunkách. Použitím ortotopického modelu gliómu u imunodeficientných myší sa výskumníci zamerali na PTBP1 terapiou založenou na antisense oligonukleotidoch (ASO), ktorá v konečnom dôsledku potlačila rast nádoru.
„Naše údaje zdôrazňujú úlohu alternatívneho zostrihu RNA pri ovplyvňovaní malignity a heterogenity gliómu a jeho potenciál ako terapeutickej zraniteľnosti pri liečbe dospelých gliómov,“ napísali autori štúdie.
Ďalším krokom pre výskumníkov je preskúmať potenciál zacielenia na PTBP1 na vyvolanie protinádorovej imunitnej odpovede, povedal Song.
„Použitím analýzy sekvenovania RNA s dlhým čítaním sme zistili, že zacielenie na PTBP1 v gliómových bunkách vedie k produkcii viacerých alternatívne zostrihaných transkriptov, ktoré v normálnych tkanivách chýbajú. Naším ďalším projektom je teda zistiť, či táto izoforma dokáže generovať niektoré antigény, aby imunitný systém mohol lepšie rozpoznať nádor,“ povedal Song.
Song tiež dodal, že ich tím má záujem analyzovať zmeny zostrihu v nenádorových bunkách od pacientov s gliómom, ako sú napríklad imunitné bunky.
„Už vieme, že zostrih je veľmi dôležitý pre reguláciu funkcií v bunke, takže by mal regulovať nielen malignitu nádoru, ale môže regulovať aj funkciu imunitných buniek, aby sa určilo, či dokážu účinne ničiť rakovinu. Preto robíme aj niektoré bioinformatické analýzy v imunitných bunkách infiltrovaných nádorom, aby sme zistili, či dochádza k zmene v zostrihu po tom, čo imunitná bunka infiltrovala nádor.“
„Naším cieľom je určiť úlohu alternatívneho zostrihu pri formovaní imunosupresívneho nádorového mikroprostredia a identifikovať potenciálne ciele na zlepšenie účinnosti imunoterapií pri glióme,“ povedal Song.
