Nové publikácie
Štúdia zdôrazňuje potrebu terapie HIV špecifickej pre jednotlivé typy buniek.
Posledná kontrola: 02.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Výskumníci z University of Illinois preukázali dôležitosť zacielenia na špecifické typy buniek pri liečbe HIV. Ich štúdia, publikovaná v časopise Proceedings of the National Academy of Sciences, je jednou z prvých, ktorá sa zaoberá diferenciálnymi alebo typovo špecifickými účinkami modulácie latencie HIV na myeloidné bunky, čo je typ imunitných buniek produkovaných v kostnej dreni.
Jednou z hlavných prekážok eliminácie infekcie HIV je zvládnutie latencie, čiže obdobia, počas ktorého infikovaná bunka leží v latentnom stave a nemôže produkovať vírus. Latentné bunky HIV sa v tele zhromažďujú na miestach známych ako rezervoáre. Latentné rezervoáre sú problematické, pretože môžu začať produkovať vírus kedykoľvek.
Úplná eradikácia ochorenia by si vyžadovala odstránenie všetkých latentných buniek z tela alebo trvalú rezistenciu voči aktivačným stimulom. Reaktiváciu však môže spustiť množstvo faktorov vrátane signálov, ktoré riadia diferenciáciu myeloidných buniek.
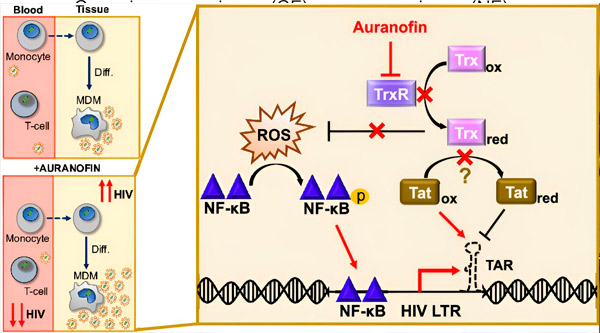
Regulácia latencie HIV v makrofágoch odvodených z monocytov (MDM) môže predstavovať riziko pre šírenie vírusu. Diferenciácia monocytov na makrofágy môže spustiť reaktiváciu HIV, čo potenciálne podporuje šírenie vírusu v tkanivách (vľavo hore). Klinický kandidát, Auranofin, znižuje vírusovú DNA v krvi a podporuje latenciu HIV v T bunkách a monocytoch, ale spôsobuje reaktiváciu HIV v MDM (vľavo dole). V MDM predpokladáme, že inhibícia TrxR pomocou Auranofin vedie k akumulácii reaktívnych foriem kyslíka (ROS), čo indukuje aktiváciu NF-κB a aktiváciu promótora HIV LTR (vpravo). Inhibícia TrxR potenciálne znižuje redukciu substrátu, čo umožňuje proteínu Tat zostať prednostne oxidovaný, kde sa môže viazať na TAR a iniciovať transkripciu HIV. Zdroj: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Výskum liečby HIV sa roky sústreďoval na dva prístupy známe ako „šok a zabitie“ a „blokovanie a uzamknutie“. Prvý funguje v kombinácii s antiretrovírusovou terapiou na aktiváciu latentne infikovaných buniek a ich zabitie prostredníctvom apoptózy alebo programovanej bunkovej smrti, zatiaľ čo druhý núti infikované bunky do hlbokého latentného stavu, z ktorého sa nemôžu samy reaktivovať.
Výskum týchto techník sa tradične zameriaval na typ bielych krviniek nazývaných T bunky, ktoré sú primárnym cieľom infekcie HIV. Latentné rezervoáre však pozostávajú z viac než len T buniek; v skutočnosti obsahujú desiatky rôznych typov buniek, z ktorých každý má svoje vlastné jedinečné vzorce expresie génov HIV.
„Existuje obrovská rozmanitosť buniek, dokonca aj v rámci jednej línie,“ povedal Collin Kieffer, odborný asistent mikrobiológie a autor článku. „Variabilita odpovede v týchto rezervoároch sa zvyšuje s každým novým typom bunky.“
Alexandra Blanco, doktorandka v Kiefferovom laboratóriu, chcela študovať typy buniek, ktoré boli v tradičnom výskume HIV prehliadané. Zamerala sa na myeloidné bunky a vytvorila klonovú knižnicu obsahujúcu 70 populácií latentne infikovaných monocytov. Blanco potom analyzovala klonálne populácie a ich reakcie na aktiváciu. Reakcie sa značne líšili, čo zdôraznilo veľkú rozmanitosť v rámci jedného bunkového typu.
Toto pozorovanie vyvolalo novú otázku: naozaj majú rôzne typy buniek odlišné reakcie na liečbu latencie HIV? Ich zistenia skutočne ukázali, že niektoré terapie latencie HIV môžu podporovať latenciu v T bunkách a monocytoch, zatiaľ čo môžu zvrátiť latenciu v makrofágoch.
„Nie všetky bunky v tele sú rovnaké,“ povedal Kieffer. „Preto dáva zmysel, že nie všetky infikované bunky budú reagovať na vírus rovnakým spôsobom.“
Ich článok zdôrazňuje potrebu, aby budúce liečby HIV zohľadňovali všetky typy buniek a to, ako by každá bunka mohla reagovať na potenciálne terapie.
Ich zistenia vychádzajú z výskumu Roya Dara, bývalého profesora bioinžinierstva v Illinois, ktorého laboratórium študovalo heterogenitu v génovej expresii HIV.
„On to začal a my sme to prevzali a vybudovali sme to tam, kde je to dnes,“ povedal Kieffer. „Táto spolupráca teda skutočne odštartovala tieto výsledky. Pre naše laboratórium sa to zmenilo na nový smer a sme z toho naozaj nadšení.“
Ďalší a neočakávaný nález z Blancovej analýzy odhalil zmeny vo veľkosti a tvare buniek v reakcii na infekciu, čo naznačuje, že HIV môže zmeniť morfológiu buniek. Blancov ďalším cieľom je identifikovať biologické mechanizmy, ktoré sú základom týchto fenotypových zmien.
Kieffer a členovia jeho laboratória sa tiež tešia na reprodukciu svojich výsledkov, ktoré boli väčšinou získané na bunkovej línii, v primárnych bunkách. Reprodukcia výsledkov v modeli podobnom človeku by zlepšila klinický význam štúdie, vysvetlil Kieffer.
„Radi by sme vykonali rozsiahlejšie skríningy T buniek, monocytov a makrofágov, aby sme identifikovali potenciálne lieky, ktoré by mohli pôsobiť na všetky tieto typy buniek,“ povedal Blanco. „Možno nájdeme ešte viac molekúl, ktoré sa nesprávajú špecifickým spôsobom pre daný typ bunky.“
