Lekársky expert článku
Nové publikácie
Experimentálne modely osteoartrózy
Posledná kontrola: 07.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
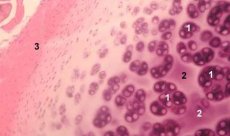
Chrupavka je vysoko špecializované tkanivo obsahujúce iba jeden typ buniek (chondrocyty) a charakterizované absenciou krvných a lymfatických ciev. Chrupavka je vyživovaná prevažne absorpciou zo synoviálnej tekutiny. Metabolizmus chondrocytov je regulovaný množstvom rozpustných faktorov produkovaných lokálne chondrocytmi a okolitými tkanivami. Funkcia chondrocytov závisí aj od zloženia extracelulárneho prostredia (tenzia kyslíka, koncentrácia iónov, pH atď.), zloženia extracelulárnej hmoty (ECM), interakcie buniek a matrice a fyzikálnych signálov. Hlavným cieľom experimentálneho modelovania je vytvoriť kultúry v extracelulárnom prostredí bez zmeny fenotypu zrelých buniek. Druhým cieľom je vytvoriť kultúry na štúdium predčasnej, oneskorenej, krátkodobej alebo dlhodobej reakcie chondrocytov na chemické a/alebo fyzikálne signály. Štúdie in vitro tiež poskytujú príležitosť študovať správanie chondrocytov pri osteoartróze. Tretím cieľom je vyvinúť systémy kokultivácie, ktoré umožňujú študovať interakcie rôznych tkanív v kĺbe. Štvrtou úlohou je príprava chrupavkových implantátov na následnú transplantáciu. A nakoniec, piatou úlohou je štúdium rastových faktorov, cytokínov alebo terapeutických látok, ktoré sú schopné stimulovať reparáciu a/alebo inhibovať resorpciu chrupavky.
V priebehu posledných desaťročí boli vytvorené rôzne modely bunkových kultúr kĺbovej chrupavky, vrátane monovrstvových kultúr, suspendovaných kultúr, chondronových kultúr, explantátov, kokultúr a nesmrteľných bunkových kultúr. Každá kultúra má svoje výhody a nevýhody a každá je vhodná na štúdium jedného špecifického aspektu metabolizmu chondrocytov. Explantáty chrupavky sú preto vynikajúcim modelom na štúdium obratu prvkov matrice, čo vyžaduje skutočné receptory na bunkovom povrchu a normálne interakcie medzi bunkami, ako aj medzi bunkami. Zároveň sa odporúča študovať usadeniny matrice alebo mechanizmy regulujúce metabolizmus chondrocytov na kultúre izolovaných buniek. Na štúdium procesu diferenciácie buniek je nevyhnutná monovrstvová kultúra s nízkou hustotou. Kultúry suspendované v prírodnej alebo syntetickej matrici sú modelom na analýzu adaptívnej reakcie chondrocytov na mechanické namáhanie.
Kultúry chondrocytov
Pri výbere chrupavkového tkaniva pre štúdie in vitro je potrebné zvážiť niekoľko dôležitých bodov. Zloženie matrice a metabolická aktivita chondrocytov sa medzi kĺbmi líšia a tá závisí aj od hĺbky umiestnenia chondrocytov v tkanive. Tieto údaje boli získané v niekoľkých experimentoch, v ktorých boli študované izolované subpopulácie chondrocytov z chrupavkových zón rôznych hĺbok. Medzi kultivovanými chondrocytmi nachádzajúcimi sa v povrchových a hlbokých vrstvách kĺbovej chrupavky sa zistilo množstvo morfologických a biochemických rozdielov. Povrchové bunky syntetizujú riedku, na proteoglykány chudobnú fibrilárnu matricu, zatiaľ čo hlbšie bunky produkujú matricu bohatú na fibrily a proteoglykány. Okrem toho povrchové bunky produkujú relatívne viac malých neagregovaných proteoglykánov a kyseliny hyalurónovej a relatívne menej agrekánu a keratansulfátu ako hlbšie chondrocyty. Ďalším dôležitým charakteristickým znakom metabolizmu chondrocytov izolovaných z chrupavkových zón rôznych hĺbok je reakcia na exogénny stimul. Podľa M. Aydelotte a kol. boli hovädzie chondrocyty z povrchovej zóny chrupavky citlivejšie na IL-1 ako bunky z hlbokej zóny.
Správanie buniek závisí aj od umiestnenia tkaniva. Chondrocyty z rebier a chrupavky ucha z toho istého zvieraťa reagujú odlišne na rastové faktory, ako je fibroblastový rastový faktor (FGF) a TGF-beta. FGF zvýšil inkorporáciu tymidínu, prolínu a leucínu do kultivovaných rebier, ale nie do ušných chondrocytov. TGF-beta zvýšil inkorporáciu tymidínu do chondrocytov rebier a chrupavky ucha, ale nemal žiadny vplyv na inkorporáciu tymidínu a prolínu do ušných chondrocytov. Chrupavkové bunky z oblastí s vysokým stresom sa líšia od buniek z oblastí s nízkym stresom na chrupavku. Chondrocyty zrelej chrupavky kolenného kĺbu oviec z centrálnej oblasti kĺbového povrchu holennej kosti, ktorá nie je pokrytá meniskom, ktorý nesie najväčšiu záťaž in vivo, syntetizujú menej agrekánu, ale viac dekorínu ako bunky zo zón pokrytých meniskom. Autori tiež zdôrazňujú dôležitosť použitia chrupavky z identických kĺbových zón pri štúdiu syntetickej funkcie kĺbov.
Metabolizmus chondrocytov a ich reakcia na regulačné faktory tiež významne závisia od veku darcu, vývoja jeho kostry a stavu kĺbov, z ktorých sa bunky odoberajú. U ľudských chondrocytov sa pozoruje významný pokles proliferatívnej odpovede s vekom. Najväčší pokles sa pozoruje u darcov vo veku 40 – 50 rokov a nad 60 rokov. Okrem toho sa závažnosť proliferatívnej odpovede na rastové faktory (napr. FGF a TGF-beta) so starnutím znižuje. Okrem kvantitatívnych zmien v proliferácii chondrocytov dochádza aj ku kvalitatívnym zmenám. Bunky od mladých darcov (10 – 20 rokov) reagujú lepšie na rastový faktor odvodený z krvných doštičiek (PDGF) ako na TGF-beta, zatiaľ čo u buniek od dospelých darcov sa pozoruje opak. Na vysvetlenie zmien v syntetickej funkcii chondrocytov a ich reakcie na rastové faktory závislých od veku sa používa niekoľko mechanizmov. Patria sem zníženie počtu a afinity povrchových bunkových receptorov, zmeny v syntéze a bioaktivite rastových faktorov a cytokínov a modifikácia postreceptorových signálov.
Patologický stav kĺbov tiež mení morfológiu a metabolickú aktivitu chondrocytov. J. Kouri a kol. (1996) tak identifikovali tri subpopulácie chondrocytov v chrupavke pri osteoartróze. Chondrocyty z povrchovej a hornej časti strednej časti chrupavky tvoria zhluky a syntetizujú väčšie množstvo proteoglykánov a kolagénu. TGF-beta a inzulínu podobný rastový faktor (IGF) sú schopné stimulovať syntézu proteoglykánov chondrocytmi a čiastočne neutralizovať účinky IL-1 a TNF-a. Explantáty chrupavky postihnutej osteoartrózou a chondrocyty izolované z chrupavky pacienta s osteoartrózou sú citlivejšie na stimuláciu TGF-beta ako chondrocyty zdravej chrupavky. Tieto rozdiely sú s najväčšou pravdepodobnosťou spojené s fenotypovými zmenami chondrocytov v horných vrstvách kĺbovej chrupavky.
Izolácia jednotlivých chondrocytov sa dosahuje postupným ošetrením extracelulárneho maternicového tkaniva (ECM) proteolytickými enzýmami. Po uvoľnení z ECM sú izolované bunky ideálne na štúdium de novo syntézy zložiek matrice. Niektorí autori používajú iba klostrídiovú kolagenázu, zatiaľ čo iní predinkubujú chrupavku s trypsínom, pronázou, DNázou a/alebo hyaluronidázou. Počet izolovaných buniek závisí od použitých enzýmov. Pri ošetrení samotnou kolagenázou je teda možné z 1 g tkaniva získať 1,4 – 106 chondrocytov, zatiaľ čo pri použití pronázy, hyaluronidázy a kolagenázy – 4,3 –106. Pri ošetrení kolagenázou zostávajú agrekán, proteíny, IL-6 a IL-8 v bunkovej kultúre v podstatne väčších množstvách ako pri postupnom ošetrení rôznymi enzýmami. Existuje niekoľko vysvetlení týchto rozdielov medzi týmito dvoma bunkovými kultúrami:
- Bunkové receptory sú poškodené alebo inhibované enzýmami, TGF-beta inhibuje syntézu DNA a proteoglykánov v čerstvo izolovaných chondrocytoch (1. deň), zatiaľ čo syntéza DNA a proteoglykánov v chondrocytoch kultivovaných v monovrstve (7 dní) je stimulovaná TGF-beta. Pred začiatkom experimentu je však potrebný dostatočný čas na opätovnú expresiu týchto membránových zložiek.
- Exogénne proteázy môžu narušiť interakciu medzi bunkou a matricou sprostredkovanú integrínmi. Rodina integrínov podporuje pripojenie chondrocytov k molekulám ECM (Shakibaei M. a kol., 1997). Toto narušenie môže ovplyvniť expresiu génov matrice.
- Zvyšky zložiek matrice môžu regulovať syntetickú funkciu chondrocytov. Integríny sú schopné rozpoznať produkty degradácie extracelulárneho matrixu (ECM), a preto hrajú dôležitú úlohu v oprave tkanív po pôsobení proteolytických enzýmov. T. Larsson a kol. (1989) uviedli, že pridanie intaktných alebo fragmentovaných proteoglykánov do bunkovej kultúry stimuluje syntézu proteínov a proteoglykánov. Vysoká hladina kyseliny hyalurónovej však spôsobuje významný pokles začlenenia sulfátov do syntézy proteoglykánov chondrocytmi kuracieho embrya, zrelými chondrocytmi prasacích a potkaních buniek chondrosarkómu. Kyselina hyalurónová je navyše inhibítorom uvoľňovania proteoglykánov z buniek aj v prítomnosti IL-1b, TNF-a, FGF, čo naznačuje pôsobenie proti prvej biologickej aktivite rastových faktorov a cytokínov. Presný mechanizmus účinku kyseliny hyalurónovej zostáva nejasný; je známe, že chondrocyty obsahujú receptor pre kyselinu hyalurónovú spojený s aktínovými filamentmi cytozolu. Väzba kyseliny hyalurónovej na jej receptor stimuluje fosforyláciu proteínov. Tieto údaje teda demonštrujú moduláciu metabolickej funkcie chondrocytov fragmentovanými alebo natívnymi molekulami proteínov matrice prostredníctvom aktivácie receptorov bunkovej membrány.
- Rýchla stimulácia syntézy proteínov matrice chondrocytmi enzýmami môže byť dôsledkom zmien tvaru chondrocytov a/alebo reorganizácie cytoskeletu.
- Niektoré cytokíny (napr. IL-8) a rastové faktory (napr. IGF-1, TGF-β) sú sekvestrované v extracelulárnom matrixe (ECM). Najznámejším príkladom je väzba TGF-β dekorínom, čo vedie k zníženej schopnosti dekorínu indukovať rast buniek vo vaječníkových bunkách čínskeho škrečka. Zistenie, že obsah dekorínu v chrupavke sa zvyšuje s vekom, naznačuje pokles biologickej dostupnosti TGF-β so starnutím. Rastové faktory a cytokíny sa môžu uvoľňovať z úlomkov matrice počas kultivácie a následne modulovať funkciu chondrocytov.
Monovrstvová kultúra chondrocytov
Diferencovaný fenotyp chondrocytov sa vyznačuje predovšetkým syntézou kolagénu typu II a tkanivovo špecifických proteoglykánov, ako aj nízkou úrovňou mitotickej aktivity. Existujú dôkazy o tom, že pri dlhodobej kultivácii buniek v monovrstve, ako aj po niekoľkých opakovaných pasážach buniek, chondrocyty strácajú svoje sférické obrysy a získavajú predĺžený tvar podobný fibroblastom. Pri takejto fibroblastickej metaplázii sa mení aj syntetická funkcia buniek, ktorá sa vyznačuje progresívnym poklesom syntézy kolagénov typu II, IX a XI a zvýšením syntézy kolagénov typu I, III a Y. Malé neagregované proteoglykány sa syntetizujú vďaka funkčnému agrekánu. Syntéza katepsínu B a L je v diferencovaných bunkách extrémne nízka, ale zvyšuje sa v procese straty diferenciácie. Kolagenáza-1 je exprimovaná v diferencovaných chondrocytoch; pri dlhodobej kultivácii sa jej expresia znižuje, zatiaľ čo produkcia tkanivových inhibítorov metaloproteináz (TIMP) sa zvyšuje.
Diferencované chondrocyty reexprimujú kolagén diferencovaného fenotypu, keď sú prenesené z monovrstvy do suspendovanej kultúry. Proces diferenciácie pravdepodobne súvisí s tvarom buniek. Túto vlastnosť pravidelne využívajú výskumníci študujúci defektné štepy s autológnymi chondrocytmi. Malý počet buniek získaných z bioptického materiálu je možné expandovať v monovrstvovej kultúre a potom pred transplantáciou znovu vložiť do trojrozmernej matrice. Reexpresiu špecifického fenotypu dediferencovanými chondrocytmi prenesenými do agarózovej kultúry možno stimulovať TGF-β, komplexom osseín-hydroxyapatit a kyselinou askorbovou.
V reakcii na rastové faktory a cytokíny sa chondrocyty počas procesu diferenciácie modifikujú. Bunková odpoveď na cytokíny a rastové faktory sa líši medzi nediferencovanými a diferencovanými chondrocytmi. IL-1 stimuluje proliferáciu fibroblastov, zatiaľ čo rast nediferencovaných chondrocytov je inhibovaný IL-1. Syntézu DNA stimuluje IGF-1 v predĺžených, ale nie sploštených chondrocytoch. V diferencovaných chondrocytoch sú stimulačné účinky IL-1beta a TNF-a na produkciu prokolagenázy výraznejšie ako v nediferencovaných chondrocytoch.
Kultivácia chondrocytov
Kultivácia chondrocytov v suspenzii v kvapalnom médiu alebo v prírodnej či syntetickej trojrozmernej matrici stabilizuje fenotyp chondrocytov. Bunky si zachovávajú svoj guľovitý tvar a syntetizujú tkanivovo špecifické proteíny. Suspendovaná kultúra chondrocytov sa zvyčajne odporúča na štúdium tvorby novej pericelulárnej matrice. Kultúry chondrocytov v syntetických alebo prírodných absorpčných polyméroch sa používajú na implantáciu buniek do defektov chrupavky na stimuláciu regenerácie tkaniva kĺbovej chrupavky. Syntetické alebo prírodné médium pre implantované bunky musí spĺňať niekoľko požiadaviek:
- implantáty musia mať pórovitú štruktúru pre bunkovú adhéziu a rast,
- ani samotný polymér, ani jeho degradačné produkty by nemali pri implantácii in vivo spôsobovať zápal alebo toxické reakcie,
- nosič štepu musí mať schopnosť viazať sa na susednú chrupavku alebo subchondrálnu kosť,
- prírodná alebo syntetická matrica musí mať schopnosť absorpcie, jej degradácia musí byť vyvážená regeneráciou tkaniva,
- Aby sa uľahčila oprava chrupavky, chemická štruktúra a architektúra pórov matrice musia uľahčovať udržiavanie bunkového fenotypu a syntézu tkanivovo špecifických proteínov chondrocytmi, ktoré sú v nej umiestnené,
- Počas implantácie in vivo je potrebné študovať mechanické vlastnosti syntetickej alebo prírodnej matrice.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Suspenzia chondrocytov v kvapalnej fáze
Prichyteniu buniek k plastovým nádobám, v ktorých sa chondrocyty kultivujú, sa dá zabrániť potiahnutím ich stien roztokom metylcelulózy, agarózy, hydrogélu (poly-2-hydroxyetylmetakrylát) alebo zmesou kolagénu a agarózy. Za týchto podmienok chondrocyty tvoria zhluky a syntetizujú hlavne agrekány a tkanivovo špecifické kolagény (typy II, IX, XI). Zvyčajne sa nachádzajú dva typy buniek. Bunky umiestnené v strede si zachovávajú guľovitý tvar a sú obklopené dobre vyvinutou extracelulárnou matrix (ECM), čo potvrdzujú histochemické a ultraštrukturálne štúdie. Na periférii majú chondrocyty diskovité obrysy a sú obklopené riedkou extracelulárnou matrix; o funkčných vlastnostiach takýchto buniek sa vie len málo.
Chondrocyty je možné kultivovať na mikronosičoch udržiavaných v suspenzii; ako mikronosiče sa používajú dextránové guľôčky (cytodex), kolagénom potiahnuté dextránové guľôčky (cytodex III) a neporézne mikroguľôčky kolagénu typu I (cellagen). Za týchto kultivačných podmienok sa chondrocyty prichytia na povrch mikronosiča, zachovajú si svoj guľovitý tvar a vytvoria materiál podobný matrici. Okrem toho použitie cellagenu podporuje proliferáciu chondrocytov a reexpresiu normálneho fenotypu. Preto sa kultivácia chondrocytov na mikroguľôčkach cellagenu môže použiť na obnovenie bunkového fenotypu pred transplantáciou.
Ďalšou metódou kultivácie suspenzie chondrocytov v tekutom médiu je ich kultivácia vo forme hustých guľôčok pozostávajúcich z buniek (0,5-1 * 10 b ), získaných centrifugáciou. Takéto chondrocyty sú schopné produkovať matricu obsahujúcu veľké množstvo proteoglykánov, kolagén typu II, ale nie kolagén typu I, čo je potvrdené histologickými, imunohistochemickými a kvantitatívnymi metódami.
Suspenzia chondrocytov v prirodzenom ECM
Chondrocyty sa môžu kultivovať v suspenzii v trojrozmernej matrici (mäkký agar, agaróza, kolagénový gél alebo špongia, kyselina hyalurónová, fibrínové lepidlo, alginátové guľôčky).
Chondrocyty kultivované v agaróze si zachovávajú svoj normálny fenotyp a syntetizujú kolagén typu II a tkanivovo špecifické agregáty agrekánov. Pri kultivácii v agaróze sa proteoglykány syntetizované bunkou uvoľňujú do média počas 50 dní. Pre porovnanie, v monovrstvovej kultúre je bunková fáza preplnená glykozaminoglykánmi už v prvých 5-6 dňoch kultivácie; pri kultivácii v médiu po zvýšenej syntéze a uvoľňovaní glykozaminoglykánov v prvých 8-10 dňoch dochádza k ich časovo závislému poklesu. Napriek tomu sa správanie chondrocytov pri kultivácii v agaróze líši od správania in vivo. V agaróze veľké množstvo syntetizovaných agregátov agrekánov obsahuje menšie molekuly a menej molekúl ako in vivo. TGF-β stimuluje syntézu proteoglykánov v explantáte, ale znižuje syntézu agrekánov v agaróze.
Alginát je lineárny polysacharid získaný z hnedých morských rias. V prítomnosti dvojmocných katiónov, ako sú ióny Ca2 +, sa tento polymér mení na gél. Každý chondrocyt zachytený v algináte je obklopený matricou negatívne nabitých polysacharidov, ktorých póry sú porovnateľné s pórmi v hyalínovej chrupavke. Matrica tvorená chondrocytmi v alginátových guľôčkach pozostáva z dvoch kompartmentov - tenkej vrstvy bunkovej matrice zodpovedajúcej pericelulárnej a teritoriálnej matrici kĺbovej chrupavky a vzdialenejšej matrice ekvivalentnej interteritoriálnej matrici v natívnom tkanive. Na 30. deň kultivácie je relatívny a absolútny objem, ktorý zaberajú bunky a každý z dvoch kompartmentov v alginátovej guľôčke, takmer úplne identický s objemom v natívnej chrupavke. Takmer 30 dní si chondrocyty zachovávajú svoj guľovitý tvar a produkujú agrekán, ktorého hydrodynamické vlastnosti sú podobné vlastnostiam molekúl agrekánu v matrici kĺbovej chrupavky, ako aj molekuly kolagénu typov II, IX a XI. Zároveň, podobne ako v iných suspenzných kultúrach, sú na povrchu alginátových guľôčok prítomné sploštené bunky, ktoré produkujú malé množstvo molekúl kolagénu typu I, ktoré sa priamo uvoľňujú do média a nie sú zabudované do ECM. V alginátových guľôčkach sa pozoruje mierna proliferácia chondrocytov. Po 8 mesiacoch kultivácie v alginátovom géli zrelé chondrocyty nestrácajú metabolickú aktivitu a pokračujú v syntéze tkanivovo špecifického kolagénu typu II a agrekánu.
H. Tanaka a kol. (1984) skúmali difúzne vlastnosti rôznych prírodných molekúl v algináte a zistili, že molekuly väčšie ako 70 kDa nedifundovali cez alginát. Bunková kultúra v algináte je preto vhodná na štúdium regulácie biosyntézy matrice a organizácie extracelulárnej hmoty (ECM). Dostupnosť buniek kultivovaných v algináte umožňuje študovať účinok peptidových regulačných faktorov a farmakologických činidiel na transkripčnej, posttranskripčnej a translačnej úrovni.
Chondrocyty sa tiež kultivujú v matrici kolagénových vlákien typu I a II. S. Nehrer a kol. (1997) porovnávali fungovanie psích chondrocytov v poréznych kolagén-proteoglykánových polymérnych matriciach obsahujúcich kolagény rôznych typov. Zistili dôležité rozdiely v morfológii biosyntetickej funkcie chondrocytov kultivovaných v kolagénových matriciach obsahujúcich kolagén typu I a II. Bunky v matrici kolagénu typu II si zachovali svoj guľovitý tvar, zatiaľ čo v kolagéne typu I mali morfológiu podobnú fibroblastom. Navyše v matrici kolagénu typu II chondrocyty produkovali väčšie množstvo glykozaminoglykánov. J. van Susante a kol. (1995) porovnávali vlastnosti chondrocytov kultivovaných v alginátovom a kolagénovom (typ I) géli. Autori zistili významný nárast počtu buniek v kolagénovom géli, ale od 6. dňa kultivácie bunky stratili svoj charakteristický fenotyp a zmenili sa na bunky podobné fibroblastom. V alginátovom géli sa pozoroval pokles počtu buniek, ale chondrocyty si zachovali svoj normálny fenotyp. V kolagénovom géli bol počet proteoglykánov na bunku výrazne vyšší ako v algináte, ale v géli sa pozoroval pokles syntézy prvkov matrice, počnúc 6. dňom kultivácie, zatiaľ čo v algináte sa syntéza naďalej zvyšovala.
Pevná trojrozmerná fibrínová matrica je prírodná látka, ktorá v sebe udržiava suspendované chondrocyty v diferencovanom fenotype. Trojrozmerná fibrínová matrica sa môže použiť aj ako nosič pri transplantácii chondrocytov. Výhodami fibrínu sú absencia cytotoxicity, schopnosť vyplniť priestor a adhézna kapacita. Histologické a biochemické štúdie, autorádiografia a elektrónová mikroskopia ukázali, že chondrocyty vo fibrínovom géli si zachovávajú svoju morfológiu, proliferujú a produkujú matricu aj po 2 týždňoch kultivácie. G. Homminga a kol. (1993) však uviedli, že rozpad fibrínu začína po 3 dňoch kultivácie a dediferenciácia chondrocytov postupuje.
Suspenzia chondrocytov v umelom (syntetickom) ECM
Chrupavkové implantáty pre rekonštrukčnú alebo ortopedickú chirurgiu je možné získať pestovaním izolovaných chondrocytov in vitro v syntetickej biokompatibilnej matrici.
Chondrocyty kultivované v kyseline polyglykolovej proliferujú a zachovávajú si normálnu morfológiu a fenotyp počas 8 týždňov. Komplex chondrocytov a kyseliny polyglykolovej pozostáva z buniek, glykozaminoglykánov, kolagénov a má vonkajšiu kolagénovú kapsulu. Takéto implantáty však obsahujú dva typy molekúl kolagénu – I a II. Implantáty z chondrocytov dediferencovaných sériou pasáží majú väčšie množstvo glykozaminoglykánov a kolagénov ako implantáty z primárne nediferencovaných chondrocytov.
L. Freed a kol. (1993b) porovnávali správanie ľudských a hovädzích chondrocytových kultúr vo vláknitej kyseline polyglykolovej (FPGA) a pórovitej kyseline polymliečnej (PPLA). Po 6-8 týždňoch kultivácie hovädzích chondrocytov v FPGA alebo PPLA autori pozorovali proliferáciu buniek a regeneráciu chrupavkovej matrice. V FPGA mali chondrocyty guľovitý tvar a nachádzali sa v lakúnach obklopených chrupavkovou matricou. Po 8 týždňoch kultivácie in vitro obsahovalo regenerované tkanivo až 50 % sušiny (4 % bunkovej hmotnosti, 15 % glykozaminoglykánov a 31 % kolagénu). V PPLA mali bunky vretenovitý tvar a malé množstvo glykozaminoglykánov a kolagénu. V FPGA bol rast buniek 2-krát intenzívnejší ako v PPLA. In vivo chondrocyty pestované vo VPGK a PPLC vytvorili tkanivo histologicky podobné chrupavke v priebehu 1-6 mesiacov. Implantáty obsahovali glykozaminoglykány, kolagény typu I a II.
Chondrocyty bovinných plodov boli kultivované v pórovitom hydrofóbnom a hydrofilnom polyetyléne s vysokou hustotou. Po 7 dňoch inkubácie v oboch substrátoch si bunky zachovali guľovitý tvar a obsahovali prevažne kolagén typu II. Po 21 dňoch kultivácie sa zistilo, že hydrofilná matrica obsahuje viac kolagénu typu II ako hydrofóbna matrica.
Chrupavkové tkanivo je možné získať aj kultiváciou v monovrstve na filtroch Millicell-CM. Predbežné potiahnutie filtrov kolagénom je nevyhnutné na pripojenie chondroitínov. Histologické vyšetrenie kultúry preukazuje akumuláciu chondrocytov v extracelulárnom chrupavkovom tkanive (ECM) obsahujúcich proteoglykány a kolagén typu II. Kolagén typu I nebol v takejto kultúre detegovaný. Chondrocyty v získanom chrupavkovom tkanive majú guľovitý tvar, ale na povrchu tkaniva sú trochu sploštené. Hrúbka novovytvoreného tkaniva sa časom zväčšovala a závisela od počiatočnej hustoty bunkovej monovrstvy. Za optimálnych kultivačných podmienok dosiahla hrúbka chrupavkového tkaniva 110 μm, organizácia jeho buniek a kolagénu do povrchových a hlbokých vrstiev je podobná ako v kĺbovej chrupavke. ECM obsahuje približne 3-krát viac kolagénu a proteoglykánov. Po 2 týždňoch kultivácie sa pozorovala akumulácia matrice, čo umožnilo extrahovať tkanivo z filtra a použiť ho na transplantáciu.
Sims a kol. (1996) študovali kultiváciu chondrocytov v polyetylénoxidovom géli, čo je enkapsulovaná polymérna matrica, ktorá umožňuje prenos veľkého množstva buniek injekciou. Šesť týždňov po injekcii do podkožného tkaniva atymických myší sa vytvorila nová chrupavka, ktorá bola morfologicky charakterizovaná bielou opalescenciou podobnou hyalínovej chrupavke. Histologické a biochemické údaje naznačovali prítomnosť aktívne proliferujúcich chondrocytov produkujúcich extracelulárny chrupavkový materiál (ECM).
Explantácia
Explantácia chrupavkového tkaniva sa používa na štúdium procesov ana- a katabolizmu v ňom, udržiavania homeostázy, resorpcie a opravy. Chondrocyty v explantátoch chrupavky si zachovávajú normálny fenotyp a zloženie ECM podobné ako v kĺbovej chrupavke in vivo. Po 5 dňoch kultivácie v prítomnosti séra sa dosiahne konštantná úroveň syntézy a prirodzených degradačných procesov. Resorpciu tkaniva je možné urýchliť v hlavnej kultúre a v kultúre s pridaním séra pomocou množstva činidiel, ako sú IL-IB, TNF-a, bakteriálne lipopolysacharidy, deriváty kyseliny retínovej alebo aktívne kyslíkové radikály. Na štúdium opravy chrupavky sa jej poškodenie indukuje rozpustnými zápalovými mediátormi (H 2 O 2, IL-1, TNF-a) alebo fyzikálnym pretrhnutím matrice.
Metóda organotypovej kultivácie je modelom pre in vitro štúdie účinkov izolovaných vonkajších faktorov na chondrocyty a okolitú matricu. In vivo sú chondrocyty riedko umiestnené v extracelulárnom médiu (ECM) a navzájom sa nedotýkajú. Kultúra explantátu kĺbovej chrupavky si zachováva túto štrukturálnu organizáciu, ako aj špecifické interakcie medzi chondrocytmi a okolitým extracelulárnym prostredím. Tento model sa tiež používa na štúdium účinkov mechanického stresu, farmakologických látok, rastových faktorov, cytokínov a hormónov na metabolizmus chrupavky.
Ďalšou výhodou explantácie chrupavkového tkaniva je absencia poškodenia chondrocytov pôsobením proteolytických enzýmov alebo mechanických faktorov, čo je pri izolácii buniek nevyhnutné. Receptory a ďalšie membránové proteíny a glykoproteíny sú chránené pred škodlivými faktormi.
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Chondrónová kultúra
Chondron je štrukturálna, funkčná a metabolická jednotka kĺbovej chrupavky pozostávajúca z chondrocytu, jeho pericelulárnej matrice a kompaktnej vláknitej kapsuly a zodpovedná za homeostázu matrice. Chondrony sa mechanicky extrahujú z chrupavky a zbierajú sa pomocou niekoľkých po sebe nasledujúcich nízkorýchlostných homogenizácií. Chondrony izolované zo zón s rôznou hĺbkou chrupavky možno rozdeliť do štyroch kategórií: jeden chondron, párové chondrony, viacnásobné (tri alebo viac) lineárne usporiadané chondrony (chondrónové stĺpce) a zhluky chondronov.
Jednotlivé chondróny sa zvyčajne nachádzajú v stredných vrstvách intaktnej chrupavky, párové chondróny sa nachádzajú na hranici strednej a hlbokej vrstvy, lineárne usporiadané viacnásobné chondróny sú typické pre hlboké vrstvy intaktnej chrupavky. Nakoniec, zhluky chondrónov pozostávajú z náhodne usporiadaných skupín jednotlivých a párových chondrónov, ktoré si po homogenizácii zachovávajú agregovaný stav. Zhluky chondrónov sú veľké fragmenty chrupavky, zvyčajne obsahujúce niekoľko chondrónov a radiálne usporiadané kolagénové fibrily, čo je typická organizačná charakteristika hlbokých vrstiev matrice. Chondróny sú imobilizované v priehľadnej agaróze, čo umožňuje štúdium ich štruktúry, molekulárneho zloženia a metabolickej aktivity. Systém chondrónov a agarózy sa považuje za mikromodel chrupavky, ktorý sa od tradičného systému chondrocytov a agarózy líši tým, že prirodzené mikroprostredie je zachované a nie je potrebné ho syntetizovať a zostavovať. Kultúra chondrónov je modelom na štúdium interakcií buniek a matrice v kĺbovej chrupavke za normálnych a patologických podmienok.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Kultúra nesmrteľných chondrocytov
Na vytvorenie permanentných bunkových línií sa používa rekombinantná DNA alebo vírusy obsahujúce onkogény, ktoré sú schopné urobiť bunku „nesmrteľnou“. Nesmrteľné chondrocyty majú schopnosť nekonečne sa množiť a zároveň si zachovať stabilný fenotyp. F. Mallein-Gerin a kol. (1995) ukázali, že onkogén SV40T indukuje proliferáciu myších chondrocytov, ktoré naďalej stabilne exprimujú kolagén typu II, IX a XI, ako aj kĺbový agrekán a väzbový proteín. Takáto bunková línia však získa schopnosť syntetizovať kolagén typu I pri kultivácii v monovrstvovej kultúre alebo na agarózovom géli.
W. Horton a kol. (1988) opísali líniu nesmrteľných buniek s nízkou úrovňou expresie mRNA kolagénu typu II. Tieto bunky boli získané ich transformáciou myším retrovírusom obsahujúcim onkogény I-myc- a y-ra. Tento typ buniek predstavuje unikátny model pre štúdium interakcií kĺbovej matrice v neprítomnosti kolagénu typu II, ako aj regulácie syntézy kolagénu typu II.
Kultúra chondrocytov s mutovanými alebo deletovanými génmi je vhodným modelom na štúdium ich fyziologickej funkcie. Tento model je obzvlášť vhodný na štúdium úlohy špecifických molekúl v organizácii chrupavkovej matrice alebo na skúmanie účinkov rôznych regulačných faktorov na metabolizmus chrupavky. Chondrocyty s deletovaným génom pre kolagén typu IX syntetizujú kolagénové fibrily, ktoré sú širšie ako normálne, čo naznačuje, že kolagén typu IX reguluje priemer fibríl. Ako je uvedené v kapitole 1, mutácia v géne COLAI kódujúcom kolagén typu II bola nedávno objavená u rodín s primárnou generalizovanou osteoartrózou. Na štúdium účinku mutantného kolagénu typu II na kĺbovú matricu R. Dharmrvaram a kol. (1997) transfekovali (infikovali cudzou nukleovou kyselinou) defektný COL 2 AI (arginín v pozícii 519 je nahradený cysteínom) do ľudských fetálnych chondrocytov in vitro.
Systém kokultúry. V kĺbe chrupavka interaguje s inými typmi buniek nachádzajúcich sa v synoviálnej membráne, synoviálnej tekutine, väzoch a subchondrálnej kosti. Metabolizmus chondrocytov môže byť ovplyvnený rôznymi rozpustnými faktormi syntetizovanými uvedenými bunkami. Pri artritíde je teda kĺbová chrupavka ničená proteolytickými enzýmami a voľnými radikálmi produkovanými synoviálnymi bunkami. Preto boli vyvinuté modely na štúdium komplexných interakcií medzi chrupavkou a okolitými tkanivami, ktoré sa nazývajú kokultúry.
S. Lacombe-Gleise a kol. (1995) kultivovali králičie chondrocyty a osteoblasty v kokultivačnom systéme (COSTAR), v ktorom boli bunky oddelené mikroporéznou membránou (0,4 μm), ktorá umožňovala výmenu medzi týmito dvoma typmi buniek bez akéhokoľvek priameho kontaktu. Táto štúdia preukázala schopnosť osteoblastov stimulovať rast chondrocytov prostredníctvom rozpustných mediátorov.
AM Malfait a spoluautori (1994) študovali vzťah medzi monocytmi periférnej krvi a chondrocytmi. Tento model je vhodný na štúdium procesov sprostredkovaných cytokínmi pri zápalových artropatiách (reumatoidná artritída, seronegatívne spondyloartritídy atď.). Autori modelu oddelili bunky membránou viažucou proteíny s pórmi s priemerom 0,4 μm. Štúdia ukázala, že monocyty stimulované lipopolysacharidom produkovali IL-1 a TNF-a, ktoré inhibovali syntézu agrekánu chondrocytmi a prispievali k degradácii už syntetizovaných agregátov agrekánu.
K. Tada a kol. (1994) vytvorili model kokultivácie, v ktorom boli endotelové bunky v kolagénovom (typ I) géli umiestnené vo vnútornej komore oddelenej od vonkajšej komory s chondrocytmi umiestnenými v nej filtrom s veľkosťou pórov 0,4 μm. V stave úplnej izolácie od vonkajšej komory ľudské endotelové bunky tvorili trubice v kolagénovom géli v prítomnosti EGF alebo TGF-a. Keď boli oba typy buniek kultivované súčasne, tvorba trubice závislá od TGF-a endotelovými bunkami bola inhibovaná. Inhibícia tohto procesu chondrocytmi bola čiastočne eliminovaná protilátkami proti TGF-beta. Dá sa predpokladať, že TGF-beta produkovaný chondrocytmi inhibuje vaskularizáciu samotnej chrupavky.
S. Groot a kol. (1994) súčasne kultivovali chondrocyty z hypertrofických a proliferačných zón kosti 16-dňového myšacieho plodu s kúskami mozgového tkaniva. Po 4 dňoch kultivácie bola pozorovaná transdiferenciácia chondrocytov na osteoblasty a začiatok tvorby osteoidov. Po 11 dňoch kultivácie bola časť chrupavky nahradená kostným tkanivom a kostná matrica bola čiastočne kalcifikovaná. Niektoré neuropeptidy a neurotransmitery produkované mozgovým tkanivom ovplyvňujú metabolizmus osteoblastov alebo pre ne majú receptory. Medzi ne patrí norepinefrín, vazoaktívny črevný peptid, peptid súvisiaci s génom kalcitonínu, substancia P a somatostatín. Kúsky mozgového tkaniva kultivované spolu s chondrocytmi môžu produkovať niektoré z uvedených faktorov schopných indukovať proces transdiferenciácie chondrocytov na osteoblasty.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Vplyv vonkajších faktorov na kultúru chondrocytov
Vplyv parciálneho tlaku kyslíka na metabolizmus chondrocytov
Vo väčšine prípadov sa kultúry chondrocytov vyvíjajú za podmienok atmosférického napätia kyslíka. Je však dobre známe, že chondrocyty in vivo existujú za hypoxických podmienok a napätie kyslíka sa mení za rôznych patologických podmienok. Počas procesu dozrievania sa pozorujú významné zmeny v prekrvení epifýz. Keďže vaskularizácia sa v rôznych zónach rastovej platničky líši, mení sa aj napätie kyslíka v nich. C. Brighton a R. Heppenstall (1971) preukázali, že v tibiálnej platničke králikov je napätie kyslíka v hypertrofickej zóne nižšie ako v okolitej chrupavke. Merania niektorých metabolických parametrov ukázali, že chondrocyty sú schopné rýchlo reagovať na lokálne zmeny koncentrácie kyslíka. V prvom rade pri nízkom napätí kyslíka sa jeho spotreba chondrocytmi znižuje. S poklesom napätia kyslíka z 21 na 0,04 % sa zvyšuje využitie glukózy, zvyšuje sa aktivita glykolytických enzýmov a syntéza kyseliny mliečnej. Aj pri nízkom napätí kyslíka zostáva absolútne množstvo ATP, ADP a AMP stabilné. Tieto údaje naznačujú, že metabolizmus chondrocytov je zameraný na maximálnu úsporu energie. Syntetická aktivita, a teda aj reparačné procesy, sa však za hypoxických podmienok menia.
Vysoký tlak kyslíka ovplyvňuje aj metabolizmus chondrocytov, čo spôsobuje zníženie syntézy proteoglykánov a DNA a degradáciu chrupavkovej matrice. Tieto účinky sú zvyčajne sprevádzané tvorbou voľných kyslíkových radikálov.
Vplyv koncentrácie iónov a osmotického tlaku prostredia na funkciu chondrocytov
V natívnej chrupavke sa koncentrácia iónov výrazne líši od koncentrácie v iných tkanivách: obsah sodíka v extracelulárnom médiu je 250 – 350 mmol a jeho osmolarita je 350 – 450 mosmol. Keď sa chondrocyty izolujú z extracelulárneho média (ECM) a inkubujú sa v štandardnom médiu (DMEM (Dulbeccovo minimálne esenciálne médium), osmolarita je 250 – 280,7 mosmol), prostredie obklopujúce bunky sa dramaticky zmení. Okrem toho je koncentrácia vápnika a draslíka v štandardnom médiu výrazne nižšia ako v natívnom tkanive a koncentrácia aniónov je výrazne vyššia.
Pridanie sacharózy do média zvyšuje jeho osmolaritu a vyvoláva prechodné intracelulárne zvýšenie koncentrácie H + a vápenatých aniónov v cytozole. Takéto intracelulárne zmeny môžu ovplyvniť procesy diferenciácie chondrocytov a ich metabolickú aktivitu. J. Urban a kol. (1993) zistili, že inkorporácia 35-8 -sulfátu a 3H -prolínu izolovanými chondrocytmi inkubovanými v štandardnom DMEM počas 2-4 hodín bola iba 10 % v porovnaní s natívnym tkanivom. Intenzita syntézy dosiahla maximum pri osmolarite extracelulárneho média 350-400 mosmol v čerstvo izolovaných chondrocytoch aj v explantátoch chrupavkového tkaniva. Okrem toho sa objem chondrocytov zvýšil o 30-40 % po umiestnení izolovaných buniek do štandardného DMEM so špecifikovanou osmolaritou. Avšak pri kultivácii chondrocytov za podmienok nefyziologickej osmolarity počas 12-16 hodín sa bunky prispôsobia novým podmienkam, čím sa intenzita biosyntézy zníži úmerne k posunu osmolarity extracelulárneho prostredia.
P. Borgetti a kol. (1995) študovali vplyv osmolarity extracelulárneho média na rast, morfológiu a biosyntézu chondrocytov ošípaných. Autori preukázali podobné biochemické a morfologické vlastnosti chondrocytov kultivovaných v médiu s osmolaritou 0,28 a 0,38 mosmol. Pri osmolarite média 0,48 mosmol sa počas prvých 4-6 hodín kultivácie pozoroval pokles proliferácie buniek a syntézy bielkovín, ale tieto parametre sa následne obnovili a nakoniec dosiahli kontrolné hodnoty. Keď sa chondrocyty kultivovali v médiu s osmolaritou 0,58 mosmol, bunky stratili schopnosť udržiavať fyziologickú intenzitu proliferačných procesov a po 6 dňoch sa počet chondrocytov významne znížil. Pri osmolarite média 0,58 mosmol sa pozorovala výrazná inhibícia syntézy bielkovín. Okrem toho, pri kultivácii v médiu s osmolaritou 0,28-0,38 mOsm si chondrocyty zachovávajú svoj fyziologický fenotyp; pri vyššej osmolarite (0,48-0,58 mOsm) dochádza k významným zmenám v morfológii buniek, čo sa prejavuje stratou charakteristického fenotypu, transformáciou chondrocytov na bunky podobné fibroblastom a stratou schopnosti buniek zostavovať matrixové proteoglykány. Výsledky tejto štúdie naznačujú schopnosť chondrocytov reagovať na obmedzené výkyvy osmolarity extracelulárneho prostredia.
Zmeny v koncentrácii iných iónov môžu tiež ovplyvniť procesy biosyntézy v chondrocytoch. Stupeň inkorporácie 35S (síranu) sa teda zvyšuje na polovicu so zvýšením koncentrácie draselných iónov z 5 mmol (koncentrácia v štandardnom DM EM médiu) na 10 mmol (koncentrácia v ECM in vivo). Koncentrácie vápnika pod 0,5 mmol podporovali produkciu kolagénu zrelými hovädzími chondrocytmi, zatiaľ čo koncentrácia 1 – 2 mmol (zodpovedajúca koncentrácii v štandardnom DM EM médiu) spôsobila významný pokles syntézy kolagénu. Pri vysokých hladinách vápnika (2 – 10 mmol) sa pozoroval mierny nárast biosyntézy. Na pripojení chondrocytov k proteínom ECM sa podieľajú rôzne katióny. Ióny horčíka a mangánu teda zabezpečujú pripojenie k fibronektínu a kolagénu typu II, zatiaľ čo ióny vápnika sa na pripojení chondrocytov k proteínom nepodieľajú. Výsledky opísaných štúdií teda naznačujú vplyv zmien extracelulárnych iónov draslíka, sodíka, vápnika a osmolarity média na biosyntetickú funkciu chondrocytov inkubovaných v štandardnom médiu.
Vplyv mechanického stresu na metabolizmus chondrocytov
Imobilizácia kĺbu spôsobuje reverzibilnú atrofiu chrupavky, čo naznačuje potrebu mechanických stimulov pre normálne metabolické procesy v extracelulárnom médiu (ECM). Vo väčšine prípadov použité modely bunkových kultúr existujú za normálneho atmosférického tlaku. M. Wright a kol. (1996) ukázali, že mechanické prostredie ovplyvňuje metabolizmus chondrocytov, pričom bunková odpoveď závisí od intenzity a frekvencie kompresného zaťaženia. Experimenty so zaťažením explantátov intaktnej kĺbovej chrupavky in vitro preukázali pokles syntézy proteínov a proteoglykánov pôsobením statického zaťaženia, zatiaľ čo dynamické zaťaženie tieto procesy stimuluje. Presné mechanizmy účinku mechanického zaťaženia na chrupavku sú zložité a pravdepodobne súvisia s deformáciou buniek, hydrostatickým tlakom, osmotickým tlakom, elektrickým potenciálom a povrchovými bunkovými receptormi pre molekuly matrice. Na štúdium vplyvu každého z týchto parametrov je potrebné vytvoriť systém, v ktorom je možné jeden parameter meniť nezávisle. Napríklad explantátová kultúra nie je vhodná na štúdium deformácie buniek, ale môže sa použiť na štúdium všeobecného vplyvu tlaku na metabolickú aktivitu chondrocytov. Kompresia chrupavky vedie k deformácii buniek a je sprevádzaná aj vznikom hydrostatického tlakového gradientu, elektrického potenciálu, prietoku tekutiny a zmenami fyzikálno-chemických parametrov, ako je obsah vody v matrici, hustota elektrického náboja a úroveň osmotického tlaku. Deformáciu buniek možno študovať pomocou izolovaných chondrocytov ponorených do agarózového alebo kolagénového gélu.
Na štúdium vplyvu mechanickej stimulácie na kultúru chondrocytov bolo vyvinutých niekoľko systémov. Niektorí výskumníci používajú systémy, v ktorých sa na bunkovú kultúru vyvíja tlak prostredníctvom plynnej fázy. Tak JP Veldhuijzen a kol. (1979) pri použití tlaku 13 kPa nad atmosférickým tlakom s nízkou frekvenciou (0,3 Hz) počas 15 minút pozorovali zvýšenie syntézy cAMP a proteoglykánov a zníženie syntézy DNA. R. Smith a kol. (1996) ukázali, že prerušované vystavenie kultúry primárnych hovädzích chondrocytov hydrostatickému tlaku (10 MPa) s frekvenciou 1 Hz počas 4 hodín spôsobilo zvýšenie syntézy agrekánu a kolagénu typu II, zatiaľ čo konštantný tlak tieto procesy neovplyvnil. Wright a kol. (1996) pri použití podobného systému uviedli, že cyklický tlak na bunkovú kultúru je spojený s hyperpolarizáciou bunkovej membrány chondrocytov a aktiváciou draslíkových kanálov závislých od Ca2 +. Účinky cyklického tlaku sú teda sprostredkované iónovými kanálmi aktivovanými natiahnutím v membráne chondrocytov. Reakcia chondrocytov na hydrostatický tlak závisí od podmienok bunkovej kultúry a frekvencie aplikovaného zaťaženia. Cyklický hydrostatický tlak (5 MPa) teda znižuje inkorporáciu sulfátov do monovrstvy chondrocytov pri frekvencii 0,05, 0,25 a 0,5 Hz, zatiaľ čo pri frekvencii vyššej ako 0,5 Hz sa inkorporácia sulfátov do explantátu chrupavky zvyšuje.
M. Bushmann a kol. (1992) uviedli, že chondrocyty v agarózových géloch menia biosyntézu v reakcii na statické a dynamické mechanické zaťaženie rovnakým spôsobom ako kultivovaný intaktný orgán. Autori zistili, že mechanické zaťaženie generuje hyperosmotický stimul s následným poklesom pH v chondrocytoch.
Vplyv mechanického naťahovania je možné študovať na bunkovej kultúre ponorenej do gélu. Naťahovaciu silu je možné vytvoriť pomocou počítačom riadeného vákua. Keď je systém pod určitým stupňom vákua, dno Petriho misky s bunkovou kultúrou sa predĺži o známu hodnotu, pričom deformácia je maximálna na okrajoch dna misky a minimálna v strede. Natiahnutie sa prenáša aj na chondrocyty kultivované v Petriho miske. Pomocou tejto metódy K. Holm-vall a kol. (1995) ukázali, že v bunkách chondrosarkómu kultivovaných v kolagénovom (typ II) géli je zvýšená expresia mRNA 2β integrínu . 2βintegrínsa dokáže viazať na kolagén typu II. Považuje sa za mechanoreceptor, pretože interaguje s proteínmi viažucimi aktín, čím spája ECM a cytoskelet.
Vplyv pH na metabolizmus chondrocytov
Hodnota pH intersticiálnej tekutiny mimosklenečnej hmoty (ECM) chrupavkového tkaniva je kyslejšia ako v iných tkanivách. A. Maroudas (1980) stanovil pH kĺbovej chrupavkovej matrice na 6,9. B. Diamant a kol. (1966) zistili za patologických podmienok pH 5,5. Je známe, že chondrocyty žijú pri nízkom PO2, čo naznačuje dôležitú úlohu glykolýzy (95 % všetkého metabolizmu glukózy) v metabolizme týchto buniek; glykolýza je sprevádzaná produkciou veľkého množstva kyseliny mliečnej.
Okrem okyslenia prostredia produktmi glykolýzy majú veľký význam aj samotné zložky matrice. Veľké množstvo fixného negatívneho náboja na proteoglykánoch modifikuje extracelulárne iónové zloženie: pozoruje sa vysoká koncentrácia voľných katiónov (napr. H +, Na +, K + ) a nízka koncentrácia aniónov (napr. O2, HCO3). Okrem toho sa pod vplyvom mechanického zaťaženia z extracelulárneho maternicového bunky (ECM) uvoľňuje voda, čo vedie k zvýšeniu koncentrácie fixných negatívnych nábojov a priťahovaniu ďalších katiónov do matrice. Toto je sprevádzané poklesom pH extracelulárneho prostredia, čo ovplyvňuje intracelulárne pH, čím sa modifikuje metabolizmus chondrocytov. R. Wilkin a A. Hall (1995) študovali vplyv pH extracelulárneho a intracelulárneho prostredia na biosyntézu matrice izolovanými hovädzími chondrocytmi. Pozorovali dvojitú modifikáciu syntézy matrice so znížením pH. Mierny pokles pH (7,4 < pH < 7,1) o 50 % zvýšil inkorporáciu 35 SO 4 a 3 H-prolínu do chondrocytov, zatiaľ čo hlbšie okyslenie média (pH < 7,1) inhibovalo syntézu o 75 % v porovnaní s kontrolou. Vytvorenie nízkeho pH (6,65) pomocou amónnych iónov spôsobilo pokles syntézy matrice iba o 20 %. Získané výsledky naznačujú, že modifikáciu pH extracelulárneho média syntézy matrice nemožno vysvetliť len zmenami pH intracelulárneho média. Chondrocyty majú navyše schopnosť regulovať intracelulárne pH pomocou Na +, H + -iónomeniča, Ka + -dependentného transportéra Cl_ - НСОС3 a H + /ATPázy.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
Vplyv zloženia kultivačného média na metabolizmus chondrocytov
Médium na kultiváciu chondrocytov musí zodpovedať experimentálnym podmienkam. V posledných rokoch sa na optimalizáciu kultivačných podmienok používa teľacie sérum. Pri použití séra je však potrebné zohľadniť niekoľko dôležitých bodov:
- rast buniek smerom von z periférie tkaniva v orgánových kultúrach,
- variabilita zloženia sér rôznych sérií,
- prítomnosť neznámych zložiek v nich,
- zvýšené riziko interferencie a artefaktov pri štúdiu vplyvu rôznych biologických faktorov na metabolickú aktivitu buniek.
Príkladom posledného je štúdia účinku EGF na chrupavkové chondrocyty u potkanov. EGF stimuloval inkorporáciu 3H -tymidínu a zvýšenie obsahu DNA v kultúre. Tento účinok bol výraznejší pri nízkych sérových koncentráciách (<1 %), ale pri vysokých koncentráciách (> 7,5 %) účinok vymizol.
Je dobre známe, že hladiny syntézy a degradácie v DMEM doplnenom teľacím sérom sú výrazne zvýšené v porovnaní s podmienkami in vivo. Rozdiely medzi metabolizmom in vivo a in vitro môžu byť spôsobené rozdielmi medzi synoviálnou tekutinou a médiom, v ktorom sa bunky kultivujú. Lee a kol. (1997) kultivovali mladé hovädzie chondrocyty v agaróze s použitím živného média obsahujúceho DMEM doplneného 20 % teľacieho séra a veľké množstvo normálnej alogénnej synoviálnej tekutiny. Prítomnosť synoviálnej tekutiny v médiu indukovala zvýšenie množstva proteoglykánov, až o 80 % celkového množstva synoviálnej tekutiny. Tieto výsledky naznačujú, že synoviálna tekutina v kultúre indukuje úroveň metabolizmu podobnú ako in vivo, s vysokou úrovňou syntézy glykozaminoglykánov a nízkou úrovňou bunkového delenia.
G. Verbruggen a kol. (1995) preukázali, že syntéza 35S -arrpeKaHa ľudskými chondrocytmi kultivovanými v agaróze v bezsérovom DMEM predstavovala 20 – 30 % úrovne syntézy pozorovanej v DMEM doplnenom o 10 % teľacieho séra. Autori určili rozsah, v akom IGF-1, IGF-2, TGF-R alebo inzulín obnovili produkciu agrekánov v bezsérovom médiu. Autori dospeli k záveru, že 100 ng/ml inzulínu, IGF-1 alebo IGF-2 čiastočne obnovilo syntézu agrekánov na 39 – 53 % kontrolnej úrovne. Pri kombinácii uvedených faktorov sa nepozoroval žiadny synergizmus ani kumulácia. Zároveň 10 ng/ml TGF-R v prítomnosti 100 ng/ml inzulínu stimulovalo syntézu agrekánov na 90 % alebo viac referenčnej úrovne. Nakoniec, ľudský sérový transferín, samostatne alebo v kombinácii s inzulínom, neovplyvnil syntézu agrekánov. Keď bolo teľacie sérum nahradené hovädzím sérovým albumínom, obsah agregátov agrekánov sa výrazne znížil. Obohatenie kultivačného média inzulínom, IGF alebo TGF-R čiastočne obnovilo schopnosť buniek produkovať agregáty agrekánov. Okrem toho sú IGF-1 a inzulín schopné udržiavať homeostázu v bunkových kultúrach. Po 40 dňoch kultivácie v médiu obohatenom o 10 – 20 ng/ml IGF-1 sa syntéza proteoglykánov udržala na rovnakej alebo dokonca vyššej úrovni v porovnaní s médiom obsahujúcim 20 % teľacieho séra. Katabolické procesy prebiehali v médiu obohatenom o IGF-1 pomalšie ako v médiu obohatenom o 0,1 % roztok albumínu, ale o niečo rýchlejšie v médiu obohatenom o 20 % séra. V dlho žijúcich kultúrach udržiava 20 ng/ml IGF-1 stabilný stav buniek.
D. Lee a kol. (1993) porovnávali vplyv zloženia kultivačného média (DMEM, DMEM + 20 % teľacieho séra, DMEM + 20 ng/ml IGF-1) na syntézu DNA v kultúre explantátu chrupavkového tkaniva, v monovrstvovej kultúre a v agarózovej suspenzii. Pri kultivácii v agaróze v prítomnosti séra autori pozorovali tendenciu chondrocytov zoskupovať sa do veľkých zhlukov. Bunky kultivované bez séra alebo s IGF-1 si v agaróze zachovali okrúhly tvar, zhromaždili sa do malých skupín, ale netvorili veľké agregáty. V monovrstve bola syntéza DNA významne vyššia v médiu obsahujúcom sérum ako v médiu obohatenom o IGF-1; syntéza DNA v druhom prípade bola významne vyššia ako v neobohatenom médiu. Nezistili sa žiadne rozdiely v syntéze DNA, keď boli chondrocyty kultivované v agarózovej suspenzii v neobohatenom médiu a v médiu s IGF-1. Zároveň bola kultivácia suspenzií chondrocytov v agaróze v médiu obohatenom sérom sprevádzaná zvýšenou inkorporáciou rádionukleotidu 3H -tymidínu v porovnaní s inými médiami.
Vitamín C je nevyhnutný pre aktiváciu enzýmov zapojených do tvorby stabilnej helikálnej štruktúry kolagénových fibríl. Chondrocyty s nedostatkom kyseliny askorbovej syntetizujú nedostatočne hydroxylované nehelikálne prekurzory kolagénu, ktoré sa vylučujú pomaly. Podávanie kyseliny askorbovej (50 μg/ml) spôsobuje hydroxyláciu kolagénu typu II a IX a ich sekréciu v normálnom množstve. Pridanie vitamínu C neovplyvnilo úroveň syntézy proteoglykánov. Preto je sekrécia kolagénu regulovaná nezávisle od sekrécie proteoglykánov.

