Lekársky expert článku
Nové publikácie
Liečba ťažkej sepsy a septického šoku
Posledná kontrola: 04.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Účinná liečba sepsy je možná len pri úplnej chirurgickej sanitácii miesta infekcie a adekvátnej antimikrobiálnej terapii. Nedostatočná počiatočná antimikrobiálna terapia je rizikovým faktorom úmrtia u pacientov so sepsou. Udržanie života pacienta, prevencia a odstránenie orgánových dysfunkcií sú možné len pri cielenej intenzívnej starostlivosti.
Jeho hlavným cieľom je optimalizácia transportu O2 za podmienok jeho zvýšenej spotreby, ktorá je typická pre ťažkú sepsu a septický šok. Táto liečba sa realizuje prostredníctvom hemodynamickej a respiračnej podpory.
Hemodynamická podpora
Infúzna terapia
Infúzna terapia je jedným z počiatočných opatrení na udržanie hemodynamiky a predovšetkým srdcového výdaja. Jej hlavnými úlohami u pacientov so sepsou sú:
- obnovenie adekvátnej perfúzie tkanív,
- korekcia porúch homeostázy,
- normalizácia bunkového metabolizmu,
- zníženie koncentrácie mediátorov septickej kaskády a toxických metabolitov.
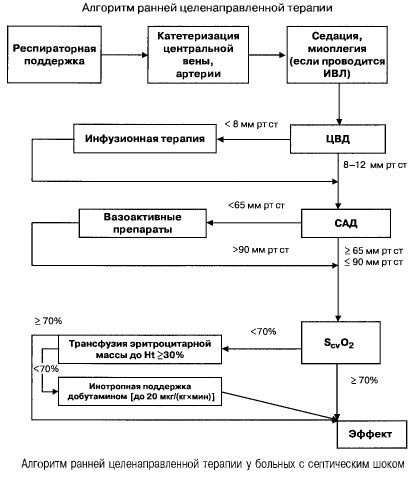
Pri sepse s viacerými orgánovými zlyhaniami a septickým šokom sa snažia rýchlo (v priebehu prvých 6 hodín) dosiahnuť nasledujúce hodnoty dôležitých ukazovateľov:
- hematokrit > 30 %,
- diuréza 0,5 ml/(kgh),
- saturácia krvi v hornej dutej žile alebo pravej predsieni > 70 %,
- priemerný krvný tlak > 65 mm Hg,
- CVP 8-12 mm Hg
Udržiavanie týchto hodnôt na stanovenej úrovni zlepšuje prežitie pacientov (kategória dôkazov B). Hemodynamické monitorovanie pomocou Swan-Ganzovho katétra a technológie PICCO (transpulmonálna termodilúcia a analýza pulznej vlny) rozširuje možnosti monitorovania a hodnotenia účinnosti hemodynamickej terapie, ale neexistujú dôkazy o tom, že by zlepšujú prežitie.
Optimálna hodnota predpätia sa volí individuálne, pretože je potrebné zohľadniť stupeň poškodenia endotelu a stav lymfatickej drenáže v pľúcach, diastolickú funkciu komôr a zmeny intratorakálneho tlaku. Objem infúznej terapie sa volí tak, aby PCWP neprekročil plazmatický COP (prevencia OL) a nedošlo k zvýšeniu CO. Okrem toho sa zohľadňujú parametre charakterizujúce funkciu výmeny plynov v pľúcach (paO2 a paO2 / FiO2 ) a zmeny v rádiografickom obraze.
Na infúznu terapiu ako súčasť cielenej liečby sepsy a septického šoku sa používajú kryštaloidné a koloidné roztoky s prakticky identickými výsledkami.
Všetky infúzne médiá majú výhody aj nevýhody. Vzhľadom na výsledky experimentálnych a klinických štúdií dnes neexistuje dôvod uprednostňovať žiadny konkrétny typ.
- Napríklad, pre adekvátnu korekciu venózneho návratu a úrovne predzáťaže je potrebné podať objem kryštaloidov 2-4-krát väčší ako objem koloidov, čo súvisí so zvláštnosťami distribúcie roztoku v tele. Okrem toho je infúzia kryštaloidov spojená s väčším rizikom tkanivového edému a ich hemodynamický účinok je kratší ako u koloidov. Zároveň sú kryštaloidy lacnejšie, neovplyvňujú koagulačný potenciál a nevyvolávajú anafylaktoidné reakcie. Na základe vyššie uvedeného sa kvalitatívne zloženie infúzneho programu určuje v závislosti od charakteristík pacienta, berúc do úvahy stupeň hypovolémie, fázu DIC syndrómu, prítomnosť periférneho edému a koncentráciu albumínu v krvnom sére, závažnosť akútneho poškodenia pľúc.
- V prípadoch závažného deficitu BCC sú indikované náhrady plazmy (dextrany, želatínové prípravky, hydroxyetylškrob). Hydroxyetylškroby so substitučným stupňom 200/0,5, 130/0,4 a 130/0,42 majú potenciálnu výhodu oproti dextranom vďaka nižšiemu riziku úniku cez membránu a absencii klinicky významného vplyvu na hemostázu.
- Podanie albumínu v kritických stavoch môže zvýšiť riziko úmrtia. Zvýšenie COP počas jeho infúzie je prechodné a potom, za podmienok zvýšenej priepustnosti kapilárneho lôžka (syndróm „kapilárneho úniku“), dochádza k ďalšiemu extravazácii albumínu. Je možné, že transfúzia albumínu bude užitočná iba vtedy, ak je jeho koncentrácia v sére nižšia ako 20 g/l a nie sú žiadne známky „úniku“ do intersticiálneho priestoru.
- Použitie kryoplazmy je indikované pri konzumnej koagulopatii a zníženom koagulačnom potenciáli krvi.
- Rozšírené používanie darcovskej erytrocytovej hmoty by malo byť obmedzené kvôli vysokému riziku vzniku rôznych komplikácií (APL, anafylaktické reakcie atď.). Podľa väčšiny odborníkov je minimálna koncentrácia hemoglobínu u pacientov s ťažkou sepsou 90-100 g/l.
Korekcia hypotenzie
Nízky perfúzny tlak vyžaduje okamžitú aktiváciu liekov, ktoré zvyšujú cievny tonus a/alebo inotropnú funkciu srdca. Dopamín alebo norepinefrín sú lieky prvej voľby na korekciu hypotenzie u pacientov so septickým šokom.
Dopamín (dopmin) v dávke <10 mcg/(kg x min) zvyšuje krvný tlak, predovšetkým zvýšením CO, a má minimálny vplyv na systémový cievny odpor. Pri vysokých dávkach prevláda jeho α-adrenergný účinok, čo vedie k arteriálnej vazokonstrikcii, a pri dávke <5 mcg/(kg x min) dopamín stimuluje dopaminergné receptory renálnych, mezenterických a koronárnych ciev, čo vedie k vazodilatácii, zvýšenej glomerulárnej filtrácii a vylučovaniu Na+.
Norepinefrín zvyšuje stredný arteriálny tlak a zvyšuje glomerulárnu filtráciu. Optimalizácia systémovej hemodynamiky pod jeho pôsobením vedie k zlepšeniu funkcie obličiek bez použitia nízkych dávok dopamínu. Štúdie z posledných rokov ukázali, že jeho izolované použitie v porovnaní s kombináciou s vysokými dávkami dopamínu vedie k štatisticky významnému poklesu mortality.
Adrenalín je adrenergné liečivo s najvýraznejšími hemodynamickými vedľajšími účinkami. Má dávkovo závislý účinok na srdcovú frekvenciu, stredný arteriálny tlak, srdcový výdaj, funkciu ľavej komory a dodávanie a spotrebu O2 . Súčasne sa však vyskytujú tachyarytmie, zhoršenie prietoku krvi orgánmi a hyperlaktatémia. Preto je použitie adrenalínu obmedzené na prípady úplnej refraktérnosti na iné katecholamíny.
Dobutamín je liekom voľby na zvýšenie dodávania a spotreby CO a O2 pri normálnom alebo zvýšenom predpätí. Vďaka svojmu prevažnému účinku na beta1-adrenergné receptory je pri zvyšovaní týchto parametrov účinnejší ako dopamín.
Experimentálne štúdie ukázali, že katecholamíny okrem podpory krvného obehu dokážu regulovať priebeh systémového zápalu ovplyvnením syntézy kľúčových mediátorov so vzdialeným účinkom. Pod vplyvom adrenalínu, dopamínu, noradrenalínu a dobutamínu aktivované makrofágy znižujú syntézu a sekréciu TNF-a.
Výber adrenergných látok sa vykonáva podľa nasledujúceho algoritmu:
- srdcový index 3,5-4 l/(min x m² ), SvO² > 70 % - dopamín alebo norepinefrín,
- srdcový index <3,5 l/(min x m2 ), SvO2 <70 % - dobutamín (ak systolický krvný tlak <70 mm Hg - spolu s norepinefrínom alebo dopamínom).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Podpora dýchania
Pľúca patria medzi prvé cieľové orgány zapojené do patologického procesu pri sepse. Akútne respiračné zlyhanie je jednou z hlavných zložiek multiorgánovej dysfunkcie. Jeho klinické a laboratórne prejavy pri sepse zodpovedajú ALI a s progresiou patologického procesu - ARDS. Indikácie pre mechanickú ventiláciu pri ťažkej sepse sa určujú v závislosti od závažnosti parenchymatózneho respiračného zlyhania (ARF alebo ARDS). Jej kritériom je respiračný index:
- <200 - je indikovaná tracheálna intubácia a respiračná podpora,
- >200 – hodnoty sa určujú individuálne.
Ak je pacient pri spontánnom dýchaní s kyslíkovou podporou pri vedomí, nie je vysoký výdaj na dýchaciu prácu a výrazná tachykardia (TF <120 za minútu), normálna hodnota venózneho návratu SO2 > 90 %, potom je možné upustiť od prevedenia na umelú ventiláciu. Je však potrebné starostlivo sledovať stav pacienta. Optimálna hodnota SO2 je okolo 90 %. Dá sa udržiavať rôznymi metódami podávania plynu (tvárové masky, nosové katétre) v netoxických koncentráciách (FiO2 < 0,6). Neinvazívna umelá ventilácia je pri sepse kontraindikovaná (kategória dôkazov B).
Treba sa vyhnúť režimom vysokoobjemovej mechanickej ventilácie (MVV) (VO2 = 12 ml/kg), pretože v takýchto prípadoch sa zvyšuje sekrécia cytokínov pľúcami, čo vedie k zhoršeniu MOF. Je potrebné dodržiavať koncept bezpečnej mechanickej ventilácie, ktorá je možná, ak sú splnené nasledujúce podmienky (kategória dôkazov A):
- Rozpustený kyslík <10 ml/kg,
- neinvertovaný pomer nádychu a výdychu,
- maximálny tlak v dýchacích cestách <35 cm H2O,
- FiO2 <0,6 .
Výber parametrov respiračného cyklu sa vykonáva dovtedy, kým sa nedosiahne adekvátna mechanická ventilácia, jej kritériá sú paO2 > 60 mm Hg, SpO2 > 88 – 93 %, pvO2 35 – 45 mm Hg, SvO2 > 55 %.
Jednou z účinných metód na optimalizáciu výmeny plynov je vykonávanie umelej ventilácie v polohe na bruchu (Prone Positioning) (kategória dôkazov B). Táto poloha je účinná u pacientov v najťažšom stave, hoci jej vplyv na zníženie úmrtnosti v dlhodobom období je štatisticky nevýznamný.
Nutričná podpora
Vykonávanie umelej nutričnej podpory je dôležitým prvkom liečby, jedným z povinných opatrení, pretože rozvoj syndrómu viacorgánového zlyhania pri sepse je zvyčajne sprevádzaný prejavmi hypermetabolizmu. V takejto situácii sú energetické potreby uspokojované deštrukciou vlastných bunkových štruktúr (autokanibalizmus), čo zhoršuje dysfunkciu orgánov a zvyšuje endotoxikózu.
Nutričná podpora sa považuje za metódu prevencie ťažkého vyčerpania (deficit bielkovín a energie) na pozadí výrazného zvýšenia kata- a metabolizmu. Zahrnutie enterálnej výživy do komplexu intenzívnej terapie zabraňuje pohybu črevnej mikroflóry, dysbakterióze, zvyšuje funkčnú aktivitu enterocytov a ochranné vlastnosti črevnej sliznice. Tieto faktory znižujú stupeň endotoxikózy a riziko sekundárnych infekčných komplikácií.
Výpočet nutričnej podpory:
- energetická hodnota - 25-35 kcal/(kg telesnej hmotnosti x deň),
- množstvo bielkovín - 1,3-2,0 g/(kg telesnej hmotnosti x deň),
- množstvo sacharidov (glukózy) - menej ako 6 g/kg/deň,
- množstvo tuku - 0,5-1 g/kg/deň,
- glutamíndipeptidy 0,3 – 0,4 g/kg/deň,
- vitamíny - štandardná denná dávka + vitamín K (10 mg/deň) + vitamíny B1 a B6 ( 100 mg/deň) + vitamíny A, C, E,
- mikroelementy - štandardná denná dávka + Zn (15-20 mg/deň + 10 mg/deň pri riedkej stolici),
- elektrolyty - Na+, K+, Ca2+ podľa bilančných výpočtov a koncentrácia v plazme.
Včasné začatie nutričnej podpory (24 – 36 hodín) je účinnejšie ako na 3. – 4. deň intenzívnej liečby (kategória dôkazov B), najmä pri enterálnej sondovej výžive.
Pri ťažkej sepse neexistujú žiadne výhody enterálnej ani parenterálnej výživy; trvanie orgánovej dysfunkcie a trvanie respiračnej a inotropnej podpory sú rovnaké a miera úmrtnosti je rovnaká. Vzhľadom na uvedené je skorá enterálna výživa lacnejšou alternatívou k parenterálnej výžive. Použitie zmesí obohatených o vlákninu (prebiotiká) na kŕmenie sondou významne znižuje výskyt hnačky u pacientov s ťažkou sepsou.
Pre účinnú syntézu bielkovín v tele je dôležité udržiavať metabolický pomer „celkový dusík, g - neproteínové kalórie, kcal“ = 1-(110-130). Maximálna dávka sacharidov je 6 g / (kg telesnej hmotnosti za deň), pretože podávanie veľkých dávok ohrozuje hyperglykémiu a aktiváciu katabolizmu v kostrovom svalstve. Tukové emulzie sa odporúča podávať nepretržite.
Kontraindikácie pre nutričnú podporu:
- dekompenzovaná metabolická acidóza,
- individuálna intolerancia na nutričné podporné médiá,
- ťažká nezotavená hypovolémia,
- refraktérny šok - dávka dopamínu > 15 mcg/(kg x min) a systolický krvný tlak < 90 mm Hg,
- ťažká nezvládnuteľná arteriálna hypoxémia.
Glykemická kontrola
Dôležitým aspektom komplexnej liečby ťažkej sepsy je neustále monitorovanie koncentrácie glukózy v krvnej plazme a inzulínová terapia. Vysoká glykémia a potreba jej korekcie sú faktormi nepriaznivého výsledku sepsy. Vzhľadom na uvedené okolnosti sa u pacientov udržiava normoglykémia (4,5-6,1 mmol/l), u ktorých sa pri zvýšení koncentrácie glukózy nad prijateľné hodnoty podáva inzulínová infúzia (0,5-1 U/h). V závislosti od klinickej situácie sa koncentrácia glukózy monitoruje každé 1-4 hodiny. Pri implementácii tohto algoritmu sa zaznamenal štatisticky významný nárast prežívania pacientov.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glukokortikoidy
Výsledky moderných štúdií týkajúcich sa účinnosti používania glukokortikoidov u pacientov so septickým šokom sú zhrnuté v nasledujúcich tvrdeniach:
- nie je vhodné používať hormóny vo vysokých dávkach [metylprednizolón 30 – 120 mg/(kg x deň) jedenkrát alebo počas 9 dní, dexametazón 2 mg/(kg x deň) počas 2 dní, betametazón 1 mg/(kg x deň) počas 3 dní] – zvýšené riziko nozokomiálnych infekcií, žiadny vplyv na prežitie,
- Použitie hydrokortizónu v dávke 240 – 300 mg denne počas 5 – 7 dní urýchľuje stabilizáciu hemodynamických parametrov, umožňuje ukončenie vaskulárnej podpory a zlepšuje prežívanie pacientov so súbežnou relatívnou adrenálnou insuficienciou (kategória dôkazov B).
Je potrebné upustiť od chaotického empirického predpisovania prednizolónu a dexametazónu - neexistujú dôvody na extrapoláciu nových informácií na ne. Pri absencii laboratórnych dôkazov o relatívnej adrenálnej insuficiencii sa podáva hydrokortizón v dávke 300 mg denne (v 3-6 injekciách).
- pri refraktérnom šoku,
- ak sú na udržanie účinnej hemodynamiky potrebné vysoké dávky vazopresorov.
Je možné, že v podmienkach systémového zápalu pri septickom šoku je účinnosť hydrokortizónu spojená s aktiváciou inhibítora nukleárneho faktora kB (NF-kB-a) a korekciou relatívnej adrenálnej insuficiencie. Inhibícia aktivity transkripčného nukleárneho faktora (NF-kB) následne vedie k zníženiu tvorby indukovateľnej NO syntetázy (NO je najsilnejší endogénny vazodilatátor), prozápalových cytokínov, COX a adhéznych molekúl.
Aktivovaný proteín C
Jedným z charakteristických prejavov sepsy je narušenie systémovej koagulácie (aktivácia koagulačnej kaskády a inhibícia fibrinolýzy), čo v konečnom dôsledku vedie k hypoperfúzii a orgánovej dysfunkcii. Účinok aktivovaného proteínu C na zápalový systém sa realizuje niekoľkými spôsobmi:
- zníženie prichytenia selektínu na leukocyty, čo chráni endotel pred poškodením, čo zohráva kľúčovú úlohu pri rozvoji systémového zápalu,
- znížené uvoľňovanie cytokínov z monocytov,
- blokovanie uvoľňovania TNF-a z leukocytov,
- inhibícia produkcie trombínu (zosilňuje zápalovú reakciu).
Antikoagulačný, profibrinolytický a protizápalový účinok
- aktivovaný proteín C je spôsobený
- degradácia faktorov Va a VIIIa - potlačenie tvorby trombov,
- potlačenie inhibítora aktivátora plazminogénu - aktivácia fibrinolýzy,
- priamy protizápalový účinok na endotelové bunky a neutrofily,
- ochrana endotelu pred apoptózou
Podávanie aktivovaného proteínu C [drotrekogín alfa (aktivovaný)] v dávke 24 mcg/(kg h) počas 96 h znižuje riziko úmrtia o 19,4 %. Indikácie na podanie: sepsa s akútnou MOF a vysokým rizikom úmrtia (APACHE II > 25 bodov, dysfunkcia 2 alebo viacerých orgánov, kategória dôkazu B).
Aktivovaný proteín C neznižuje úmrtnosť u detí, pacientov s dysfunkciou jedného orgánu, APACHE II < 25 bodov, u pacientov s nechirurgickou sepsou.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Imunoglobulíny
Vhodnosť intravenózneho podávania imunoglobulínov (IgG a IgG+IgM) je spojená s ich schopnosťou obmedziť nadmerné pôsobenie prozápalových cytokínov, zvýšiť klírens endotoxínov a stafylokokového superantigénu, eliminovať anergiu a zosilniť účinok ß-laktámových antibiotík. Ich použitie pri liečbe ťažkej sepsy a septického šoku je jedinou metódou imunokorekcie, ktorá zvyšuje prežitie. Najlepší účinok sa zaznamenal pri použití kombinácie IgG a IgM [RR=0,48 (0,35-0,75), kategória dôkazu A]. Štandardný dávkovací režim je 3-5 ml/(kg x deň) počas 3 dní po sebe. Pri použití imunoglobulínov sa najoptimálnejšie výsledky dosiahli v skorej fáze šoku („teplý šok“) a u pacientov s ťažkou sepsou (skóre APACHE II 20-25 bodov).
Prevencia hlbokej žilovej trombózy
Prevencia hlbokej žilovej trombózy dolných končatín významne ovplyvňuje výsledky liečby u pacientov so sepsou (kategória dôkazov A). Na tento účel sa používajú nefrakcionované aj nízkomolekulárne heparíny. Hlavnými výhodami nízkomolekulárnych heparínov sú nižší výskyt hemoragických komplikácií, slabší účinok na funkciu krvných doštičiek a dlhodobý účinok (možno podávať raz denne).
Prevencia tvorby stresových vredov v gastrointestinálnom trakte
Tento smer zohráva významnú úlohu v priaznivom výsledku liečby pacientov s ťažkou sepsou a septickým šokom, keďže úmrtnosť na krvácanie zo stresových vredov gastrointestinálneho traktu je 64 – 87 %. Bez preventívnych opatrení sa stresové vredy vyskytujú u 52,8 % kriticky chorých pacientov. Použitie inhibítorov protónovej pumpy a blokátorov histamínových H2 receptorov však znižuje riziko viac ako 2-krát (prvá skupina liekov je účinnejšia ako druhá). Hlavným smerom prevencie a liečby je udržiavanie pH v rozmedzí 3,5 – 6,0. Treba zdôrazniť, že okrem vyššie uvedených liekov zohráva dôležitú úlohu v prevencii vzniku stresových vredov aj enterálna výživa.
Mimotelové čistenie krvi
Rôzne biologicky aktívne látky a metabolické produkty zapojené do rozvoja generalizovaného zápalu sú cieľom detoxikačných metód, čo je obzvlášť dôležité pri absencii prirodzeného hepatorenálneho klírensu v podmienkach multiorgánového zlyhania. Metódy renálnej substitučnej terapie sa považujú za sľubné, pretože dokážu ovplyvniť nielen uremické poruchy u pacientov s renálnym zlyhaním, ale majú aj pozitívny vplyv na ďalšie zmeny homeostázy a orgánové dysfunkcie, ktoré sa vyskytujú pri sepse, šoku a multiorgánovom zlyhaní.
Doteraz neexistujú žiadne údaje potvrdzujúce potrebu použitia extrakorporálnych metód čistenia krvi ako jedného z hlavných smerov patogenetickej terapie sepsy a septického šoku. Ich použitie je opodstatnené v prípade viacorgánového zlyhania s dominanciou obličiek.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodialýza
Podstatou metódy je difúzia látok s nízkou molekulovou hmotnosťou (do 5x103 Da ) cez semipermeabilnú membránu a odstránenie prebytočnej tekutiny z tela pozdĺž tlakového gradientu. Hemodialýza sa široko používa na liečbu pacientov s chronickým aj akútnym zlyhaním obličiek. Rýchlosť difúzie látok exponenciálne závisí od ich molekulovej hmotnosti. Napríklad odstraňovanie oligopeptidov je pomalšie ako ich syntéza.
Hemofiltrácia
Hemofiltrácia je účinná metóda na odstraňovanie látok s molekulovou hmotnosťou 5x10³ - 5x10⁴ Da a jediný spôsob, ako z tela odstrániť veľkú skupinu biologicky aktívnych látok a metabolitov. Metóda je založená na konvekčnej metóde prenosu hmoty. Okrem adekvátnej korekcie azotémie hemofiltrácia účinne odstraňuje anafylatoxíny C3a, C5a, prozápalové cytokíny (TNF-a, IL-1b, 6 a 8), ß2-mikroglobulín, myoglobín, parathormón, lyzozým (molekulová hmotnosť - 6000 Da), a-amylázu (molekulová hmotnosť - 36 000-51 000 Da), kreatínfosfokinázu, alkalickú fosfatázu, transaminázy a ďalšie látky. Hemofiltrácia odstraňuje aminokyseliny a plazmatické bielkoviny (vrátane imunoglobulínov a cirkulujúcich imunitných komplexov).
Hemodiafiltrácia
Hemodiafiltrácia je najúčinnejšou metódou čistenia krvi, ktorá kombinuje difúziu a konvekciu (t. j. GD a GF). Ďalším príspevkom k procesu detoxikácie je sorpcia patologických látok na filtračnú membránu.
Plazmaferéza
Plazmaferéza (výmena plazmy, plazmová filtrácia) sa tiež považuje za možnú metódu korekcie generalizovaného zápalu u pacientov so sepsou a septickým šokom. Za optimálnu metódu sa považuje použitie plazmovej výmeny v kontinuálnom režime s odstránením 3-5 objemov plazmy a jej súčasnou náhradou za čerstvo zmrazené, albumínové, koloidné a kryštaloidné roztoky. S koeficientom preosiatia 1 plazmová filtrácia zabezpečuje dobré odstránenie C-reaktívneho proteínu, haptoglobínu, fragmentu komplementu C3, 1-antitrypsínu, IL-6, tromboxánu-B2, faktora stimulujúceho granulocyty, TNF. Použitie sorbentov na čistenie plazmy pacienta znižuje riziko infekcie a znižuje náklady na zákrok, pretože nie je potrebné používať cudzie proteíny.
Použitie dlhodobej infúzie seleničitanu sodného (selenázy) 1000 mcg/deň pri ťažkej sepse vedie k zníženiu úmrtnosti.
Selén je esenciálny mikroelement, ktorého význam sa spája s jeho kľúčovou úlohou v antioxidačných systémoch buniek. Hladina selénu v krvi sa udržiava v rozmedzí 1,9 – 3,17 μM/l. Potreba selénu je 50 – 200 μg denne a závisí od dostupnosti ďalších antioxidantov a mikroelementov.
Selén je silný antioxidant, zložka glutatiónperoxidázy, fosfolínglutatiónperoxidázy, iných oxidoreduktáz a niektorých transferáz. Glutatiónperoxidáza je najdôležitejším článkom v endogénnom antioxidačnom systéme.
Účinnosť selénu v kritických stavoch bola v posledných rokoch skúmaná. Tieto štúdie ukázali, že hlavné mechanizmy účinku selénu sú:
- potlačenie hyperaktivácie NF-kB;
- znížená aktivácia komplementu;
- jeho pôsobenie ako imunomodulátora, antioxidantu a protizápalového činidla
- udržiavanie využitia peroxidu;
- potlačenie endotelovej adhézie (znížená expresia ICAM-1, VCAM-2,
- E - selektín, P - selektín);
- ochrana endotelu pred oxyradikálmi (pomocou selenoproteínu P, ktorý zabraňuje tvorbe peroxynitritu z O2 a NO).
Zhrnutie vyššie uvedeného môžeme definovať špecifické úlohy intenzívnej starostlivosti pri ťažkej sepse:
- Hemodynamická podpora: CVP 8-12 mm Hg, priemerný TK > 65 mm Hg, diuréza 0,5 ml/(kg h), hematokrit > 30 %, saturácia zmiešanej venóznej krvi > 70 %.
- Podpora dýchania pri maximálnom tlaku v dýchacích cestách <35 cm H2O, inspiračný podiel kyslíka <60 %, dychový objem <10 ml/kg, neinvertovaný inspiračný a expiračný pomer.
- Glukokortikoidy - „nízke dávky“ (hydrokortizón 240-300 mg denne).
- Aktivovaný proteín C 24 mcg/(kg h) počas 4 dní pri ťažkej sepse (APACHE II > 25).
- Imunokorekčná substitučná terapia pentaglobínom.
- Prevencia hlbokej žilovej trombózy dolných končatín.
- Prevencia vzniku stresových vredov gastrointestinálneho traktu: použitie inhibítorov protónovej pumpy a blokátorov H2-histamínových receptorov.
- Substitučná liečba akútneho zlyhania obličiek.
- Nutričná podpora: energetická hodnota potravy 25-30 kcal/kg telesnej hmotnosti x deň), bielkoviny 1,3-2,0 g/(kg telesnej hmotnosti x deň), glutamíndipeptidy 0,3-0,4 g/(kg x deň), glukóza - 30-70 % nebielkovinových kalórií za predpokladu udržania glykémie <6,1 mmol/l, tuky - 15-50 % nebielkovinových kalórií.

