Lekársky expert článku
Nové publikácie
Vírus ľudskej imunitnej nedostatočnosti (HIV)
Posledná kontrola: 04.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Syndróm získanej imunodeficiencie bol identifikovaný ako špecifické ochorenie v roku 1981 v Spojených štátoch, keď sa u viacerých mladých ľudí vyvinuli závažné ochorenia spôsobené mikroorganizmami, ktoré boli pre zdravých ľudí nepatogénne alebo slabo patogénne. Štúdia imunitného stavu pacientov odhalila prudký pokles počtu lymfocytov vo všeobecnosti a najmä T-pomocných buniek. Tento stav bol nazvaný AIDS (syndróm získanej imunitnej nedostatočnosti). Spôsob infekcie (sexuálny kontakt, prostredníctvom krvi a jej prípravkov) naznačoval infekčnú povahu ochorenia.
Pôvodcu AIDS objavili v roku 1983 nezávisle Francúz L. Montagnier, ktorý ho nazval LAV lymfadenopathy Associated Virus (vírus asociovaný s lymfadenopatiou), keďže ho našiel u pacienta s lymfadenopatiou, a Američan R. Gallo, ktorý vírus nazval HTLV-III (ľudský T-lymfotropný vírus III): predtým objavil lymfotropné vírusy I a II.
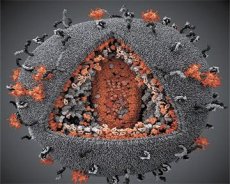
Porovnanie vlastností vírusov LAV a HTLV-III ukázalo ich identitu, a preto, aby sa predišlo zámene, bol vírus v roku 1986 pomenovaný HIV (vírus ľudskej imunodeficiencie alebo HIV). HIV má guľovitý tvar s priemerom 110 nm. Obal vírusu má tvar mnohostenu, zloženého z 12 päťuholníkov a 20 šesťuholníkov. V strede a rohoch každého šesťuholníka sa nachádza molekula glykozylovaného proteínu gpl20 (číslo 120 označuje molekulovú hmotnosť proteínu v kilodaltonoch). Na povrchu viriónu sa nachádza celkovo 72 molekúl gpl20 vo forme zvláštnych hrotov, z ktorých každý je asociovaný s intramembránovým proteínom gp41. Tieto proteíny spolu s dvojitou lipidovou vrstvou tvoria superkapsidu (membránu) viriónu.
Proteíny gpl20 a gp41 vznikajú rozštiepením prekurzorového proteínu Env bunkovou proteázou. Proteín gp41 tvorí hrotovú „stonku“ väzbou svojej cytoplazmatickej domény na matricový proteín p17MA nachádzajúci sa priamo pod obalom. Molekuly p17 interagujú počas dozrievania viriónu a vytvárajú ikozaédrón pod obalom.
V centrálnej časti viriónu tvorí proteín p24 kužeľovitý kapsid. Zúžená časť kapsidy je spojená s membránou viriónu za účasti proteínu rb. Vo vnútri kapsidy sa nachádzajú dve identické molekuly vírusovej genomickej RNA. Sú svojimi 5' koncami spojené s nukleokapsidovým proteínom p7NC. Tento proteín je zaujímavý, pretože má dva aminokyselinové zvyšky (motívy) bohaté na cysteín a histidín a obsahujúce atóm Zn – nazývajú sa „zinkové prsty“, pretože zachytávajú molekuly genomickej RNA pre inklúziu do tvoriacich sa viriónov. Kapsida tiež obsahuje tri enzýmy. Revertáza (RT), alebo pol komplex, zahŕňa reverznú transkriptázu, RNázu H a DNA-dependentnú DNA polymerázu. Revertáza je prítomná ako heterodimér p66/p51. Proteáza (PR) – p10, iniciuje a realizuje proces dozrievania viriónu. Integráza (IN) - p31 alebo endonukleáza zabezpečuje začlenenie provírusovej DNA do genómu hostiteľskej bunky. Kapsida obsahuje aj molekulu primerovej RNA (tRNA1"3).
RNA genóm v bunke sa pomocou reverznej transkriptázy premení na DNA genóm (DNA provírus), ktorý pozostáva z 9283 párov nukleotidov. Zľava a sprava je ohraničený takzvanými dlhými terminálnymi repetíciami alebo LTR: S'-LTR vľavo a 3'-LTR vpravo. LTR obsahujú po 638 párov nukleotidov.
Genóm HIV sa skladá z 9 génov, z ktorých niektoré sa na koncoch prekrývajú (majú niekoľko čítacích rámcov) a majú exonintrónovú štruktúru. Riadia syntézu 9 štrukturálnych a 6 regulačných proteínov.
Význam LTR pre vírusový genóm spočíva v tom, že obsahujú nasledujúce regulačné prvky, ktoré riadia jeho fungovanie:
- transkripčný signál (promótorová oblasť);
- signál adície poly-A;
- signál obmedzenia;
- integračný signál;
- signál pozitívnej regulácie (TAR pre proteín TAT);
- negatívny regulačný element (NRE pre proteín NEF);
- miesto pre pripojenie primeru RNA (tRNA™3) pre syntézu mínusového vlákna DNA na 3' konci; signál na 5' konci LTR, ktorý slúži ako primer pre syntézu plusového vlákna DNA.
Okrem toho LTR obsahuje prvky zapojené do regulácie zostrihu mRNA, balenia molekúl vRNA do kapsidy (prvok Psi). Nakoniec, počas transkripcie genómu sa v dlhých mRNA tvoria dva signály pre proteín REV, ktoré prepínajú syntézu proteínov: CAR - pre regulačné proteíny a CRS - pre štrukturálne proteíny. Ak sa proteín REV viaže na CAR, syntetizujú sa štrukturálne proteíny; ak chýba, syntetizujú sa iba regulačné proteíny.
Nasledujúce regulačné gény a ich proteíny hrajú obzvlášť dôležitú úlohu pri regulácii fungovania vírusového genómu:
- TAT proteín, ktorý vykonáva pozitívnu kontrolu replikácie vírusu a pôsobí prostredníctvom regulačnej oblasti TAR;
- Bielkoviny NEV a VPU, ktoré vykonávajú negatívnu kontrolu replikácie prostredníctvom oblasti NRE;
- REV proteín, ktorý vykonáva pozitívno-negatívnu kontrolu. REV proteín riadi prácu génov gag, pol, env a vykonáva negatívnu reguláciu zostrihu.
Replikácia HIV je teda pod trojitou kontrolou – pozitívnou, negatívnou a pozitívno-negatívnou.
Proteín VIF určuje infekčnosť novo syntetizovaného vírusu. Je asociovaný s kapsidovým proteínom p24 a je prítomný vo virióne v množstve 60 molekúl. Proteín NEF je vo virióne zastúpený malým počtom molekúl (5-10), pravdepodobne asociovaných s obalom.
Proteín VPR inhibuje bunkový cyklus vo fáze G2, podieľa sa na transporte preintegračných komplexov do bunkového jadra, aktivuje niektoré vírusové a bunkové gény a zvyšuje účinnosť replikácie vírusu v monocytoch a makrofágoch. Umiestnenie proteínov VPR, TAT, REV a VPU vo virióne nebolo stanovené.
Okrem vlastných proteínov môže membrána viriónu obsahovať aj niektoré proteíny hostiteľskej bunky. Proteíny VPU a VPR sa podieľajú na regulácii reprodukcie vírusu.
Antigénne varianty vírusu ľudskej imunodeficiencie (HIV)
Vírus ľudskej imunitnej nedostatočnosti (HIV) je veľmi variabilný. Aj z tela jedného pacienta je možné izolovať vírusové kmene, ktoré sa výrazne líšia antigénnymi vlastnosťami. Takúto variabilitu uľahčuje intenzívna deštrukcia buniek CD4+ a silná protilátková odpoveď na infekciu HIV. Z pacientov zo západnej Afriky bola izolovaná nová forma HIV, HIV-2, biologicky blízka HIV-1, ale imunologicky odlišná od neho. Homológia primárnej štruktúry genómov týchto vírusov je 42 %. DNA provírus HIV-2 obsahuje 9671 bp a jeho LTR - 854 bp. HIV-2 bol následne izolovaný v iných regiónoch sveta. Medzi HIV-1 a HIV-2 neexistuje skrížená imunita. Sú známe dve veľké formy HIV-1: O (Outlier) a M (Major), pričom tá druhá je rozdelená do 10 podtypov (AJ). V Rusku cirkuluje osem podtypov (AH).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mechanizmus interakcie HIV s bunkou
Po preniknutí do tela vírus najprv napáda bunky obsahujúce špecifický receptor CD4. Tento receptor je prítomný vo veľkom množstve v T-pomocných bunkách, v menšom množstve v makrofágoch a monocytoch a T-pomocné bunky sú na vírus obzvlášť citlivé.
Vírus ľudskej imunodeficiencie (HIV) rozpoznáva receptory CD4 pomocou svojho proteínu gpl20. Proces interakcie HIV s bunkou prebieha podľa nasledujúcej schémy: adsorpcia sprostredkovaná receptorom -> potiahnutá jamka -> potiahnutý vezikula -> lyzozóm. V ňom sa viriónová membrána spojí s lyzozómovou membránou a nukleokapsida uvoľnená zo superkapsidy vstupuje do cytoplazmy; na ceste do jadra sa zničí a uvoľní sa genomická RNA a súvisiace jadrové komponenty. Potom reverzná transkriptáza syntetizuje mínusový reťazec DNA na viriónovej RNA, potom RNáza H zničí viriónovú RNA a vírusová DNA polymeráza syntetizuje kladný reťazec DNA. Na koncoch DNA provírusu sa tvoria 5'-LTR a 3'-LTR. DNA provírus môže v jadre zostať nejaký čas v neaktívnej forme, ale skôr či neskôr sa pomocou svojej integrázy integruje do chromozómu cieľovej bunky. V ňom provírus zostáva neaktívny, kým daný T-lymfocyt nie je aktivovaný mikrobiálnymi antigénmi alebo inými imunokompetentnými bunkami. Aktivácia bunkovej transkripcie DNA je regulovaná špeciálnym jadrovým faktorom (NF-kB). Je to proteín viažuci DNA a produkuje sa vo veľkom množstve počas aktivácie a proliferácie T-lymfocytov a monocytov. Tento proteín sa viaže na určité sekvencie bunkovej DNA a podobné LTR sekvencie DNA provírusu a indukuje transkripciu bunkovej DNA aj DNA provírusu. Indukciou transkripcie DNA provírusu sa vykonáva prechod vírusu z neaktívneho stavu do aktívneho, a teda z perzistentnej infekcie do produktívnej. Provírus môže zostať v neaktívnom stave veľmi dlho. Aktivácia vírusu je kritickým momentom v jeho interakcii s bunkou.
Od okamihu preniknutia vírusu do bunky začína obdobie infekcie HIV - stav nosiča vírusu, ktorý môže trvať 10 rokov alebo viac; a od okamihu aktivácie vírusu začína ochorenie - AIDS. S pomocou svojich regulačných génov a ich produktov sa vírus začína aktívne rozmnožovať. Proteín TAT môže 1000-krát zvýšiť rýchlosť reprodukcie vírusu. Vírusová transkripcia je zložitá. Zahŕňa tvorbu mRNA plnej dĺžky aj subgenómovej mRNA, zostrih mRNA a následne dochádza k syntéze štrukturálnych a regulačných proteínov.
Syntéza štrukturálnych proteínov prebieha nasledovne. Najprv sa syntetizuje prekurzorový polyproteín Pr55Gag (proteín s molekulovou hmotnosťou 55 kDa). Obsahuje 4 hlavné domény: matricovú (MA), kapsidovú (CA), nukleokapsidovú (NC) a doménu rb, z ktorej v dôsledku odštiepenia Pr55Gag vírusovou proteázou (samostatne sa odštiepuje z iného prekurzorového proteínu, Gag-Pol) vznikajú štrukturálne proteíny p17, p24, p7 a rb. Tvorba polyproteínu Pr55Gag je hlavnou podmienkou pre tvorbu vírusových častíc. Práve tento proteín určuje program morfogenézy viriónu. Postupne zahŕňa fázy transportu polyproteínu Gag na plazmatickú membránu, interakciu s ňou a interakcie proteín-proteín počas tvorby vírusovej častice a jej pučania. Pr55Gag sa syntetizuje na voľných polyribozómoch; molekuly proteínov sú transportované na membránu, kde sú ukotvené svojimi hydrofóbnymi oblasťami. Doména CA hrá hlavnú úlohu pri vytváraní natívnej konformácie proteínu Gag. Doména NC zabezpečuje zahrnutie (pomocou svojich „zinkových prstov“) 2 molekúl genomickej RNA do zloženia tvoriacej sa vírusovej častice. Molekula polyproteínu sa spočiatku dimerizuje v dôsledku interakcie matrixových domén. Diméry sa potom v dôsledku interakcie domén CA a NC spoja do hexamérnych (6 jednotiek) komplexov. Nakoniec hexaméry, ktoré sa spoja na svojich bočných povrchoch, tvoria nezrelé sférické virióny, vo vnútri ktorých sa nachádza genomická vírusová RNA zachytená doménou NC.
Ďalší prekurzorový proteín, Prl60Gag-Pol (proteín s molekulovou hmotnosťou 160 kDa), sa syntetizuje v dôsledku posunu čítacieho rámca ribozómom počas translácie 3'-konca génu gag v oblasti nachádzajúcej sa bezprostredne pred oblasťou kódujúcou proteín rb. Tento polyproteín Gag-Pol obsahuje neúplnú sekvenciu proteínu Gag (1-423 aminokyselín) a sekvencie Pol, ktoré zahŕňajú domény PR, RT a IN. Molekuly polyproteínu Gag-Pol sa tiež syntetizujú na voľných polyribozómoch a sú transportované do plazmatickej membrány. Polyproteín Prl60Gagpol obsahuje všetky intermolekulárne interakčné miesta a väzbové miesta na membránu, ktoré sú vlastné polyproteínu Gag. Preto sa molekuly polyproteínu Gag-Pol fúzujú s membránou a spolu s molekulami Gag sú zahrnuté vo tvoriacich sa viriónoch, čo vedie k vzniku aktívnej proteázy a začiatku procesu dozrievania viriónu. Proteáza HIV-1 je vysoko aktívna iba vo forme diméru, preto je pre jej samovyštiepenie z Prl60Gag-Pol potrebná dimerizácia týchto molekúl. Zrenie viriónu spočíva v tom, že uvoľnená aktívna proteáza štiepi prl60Gag-Pol a Gag55 v miestach, ktoré rozpoznáva; vznikajú proteíny p17, p24, p7, p6, revertáza, integráza a dochádza k ich asociácii do vírusovej štruktúry.
Proteín Env sa syntetizuje na ribozómoch spojených s membránami endoplazmatického retikula, potom je glykozylovaný, bunkovou proteázou štiepený na gp120 a gp41 a transportovaný na povrch bunky. V tomto prípade gp41 preniká cez membránu a viaže sa na matrixové domény molekuly proteínu Gag spojené s vnútorným povrchom membrány. Toto spojenie sa zachováva aj v zrelom virióne.
Zostavenie vírusových častíc teda spočíva v agregácii prekurzorových proteínov a asociovaných molekúl RNA na plazmatickej membráne hostiteľskej bunky, tvorbe nezrelých viriónov a ich uvoľnení pučaním z bunkového povrchu. Počas pučania sa virión obklopí bunkovou membránou, do ktorej sú vložené molekuly gp41 a gp120. Počas pučania alebo prípadne po uvoľnení viriónov dochádza k ich dozrievaniu, ktoré sa uskutočňuje pomocou vírusovej proteázy a spočíva v proteolytickom štiepení prekurzorových proteínov Pr55Gag a Prl60Gag-Pol na proteíny zrelého vírusu a ich spojení do určitých štrukturálnych komplexov. Vedúcu úlohu v procesoch vírusovej morfogenézy zohráva prekurzorový polyproteín Pr55Gag, ktorý organizuje a zostavuje nezrelý virión; proces jeho dozrievania je dokončený špecifickou vírusovou proteázou.
Príčiny imunodeficiencie
Jednou z hlavných príčin imunodeficiencie pri HIV infekcii je masová smrť T-pomocných buniek. Vyskytuje sa v dôsledku nasledujúcich udalostí. Po prvé, T-pomocné bunky infikované vírusom zomierajú v dôsledku apoptózy. Predpokladá sa, že u pacientov s AIDS je replikácia vírusu, apoptóza a zníženie počtu T-pomocných buniek vzájomne prepojené. Po druhé, T-zabíjače rozpoznávajú a ničia T-bunky infikované vírusom alebo nesúce adsorbované molekuly gpl20, ako aj vírusom infikované a neinfikované T-pomocné bunky, ktoré tvoria symplasty (syncytium) pozostávajúce z niekoľkých desiatok buniek (niektoré z nich zomierajú v dôsledku reprodukcie vírusov v nich). V dôsledku deštrukcie veľkého počtu T-pomocných buniek dochádza k zníženiu expresie membránových receptorov v B-lymfocytoch pre interleukín-2, dochádza k narušeniu syntézy rôznych interleukínov (rastové faktory a diferenciačné faktory B-lymfocytov - IL-4, IL-5, IL-6 atď.), čo vedie k narušeniu funkcie systému T-zabíjačov. Aktivita komplementu a makrofágových systémov je potlačená. Makrofágy a monocyty infikované vírusom dlho neumierajú, ale nie sú schopné vírus z tela odstrániť. Nakoniec, kvôli štrukturálnej a antigénnej podobnosti gpl20 s receptormi niektorých epitelových buniek tela (vrátane receptorov trofoblastov sprostredkujúcich prenos HIV po transplantácii) sa syntetizujú antireceptorové protilátky so širokým spektrom účinku. Takéto protilátky sú schopné blokovať rôzne bunkové receptory a komplikovať priebeh ochorenia autoimunitnými poruchami. Dôsledkom infekcie HIV je poškodenie všetkých hlavných článkov imunitného systému. Takíto pacienti sa stávajú bezbrannými voči širokej škále mikroorganizmov. To vedie k rozvoju oportúnnych infekcií a nádorov. U pacientov s infekciou HIV sa zvyšuje riziko vzniku najmenej troch typov rakoviny: Kaposiho sarkóm; karcinóm (vrátane rakoviny kože); B-bunkový lymfóm, ktorý vzniká v dôsledku malígnej transformácie B-lymfocytov. HIV však nie je len lymfocytotropný, ale aj neurotropný. Preniká do buniek centrálneho nervového systému (astrocytov) ako receptormi sprostredkovanou endocytózou, tak aj fagocytózou vírusom infikovaných lymfoblastov astrocytmi. Pri interakcii vírusu s astrocytmi sa tiež tvoria symplasty, ktoré uľahčujú šírenie patogénu medzibunkovými kanálmi. Vírus môže dlhodobo pretrvávať v makrofágoch a monocytoch, takže slúžia ako jeho rezervoár a distribútor v tele a sú schopné preniknúť do všetkých tkanív. Infikované makrofágy zohrávajú hlavnú úlohu pri zavádzaní HIV do centrálneho nervového systému a jeho poškodení. U 10 % pacientov sú primárne klinické syndrómy spojené s poškodením centrálneho nervového systému a prejavujú sa ako demencia. Ľudia infikovaní HIV sú teda charakterizovaní 3 skupinami ochorení - oportúnnymi infekciami,nádorové ochorenia a poškodenie centrálneho nervového systému.
Epidemiológia HIV infekcie
Zdrojom HIV infekcie je iba človek – chorý alebo vírusonosič. Vírus ľudskej imunitnej nedostatočnosti (HIV) sa nachádza v krvi, spermiách, cervikálnej tekutine; u dojčiacich matiek v materskom mlieku. K infekcii dochádza sexuálne, prostredníctvom krvi a jej prípravkov, ako aj z matky na dieťa pred, počas a po pôrode. Prípady infekcie vírusom prostredníctvom jedla, nápojov a uhryznutia hmyzom nie sú známe.
Drogová závislosť prispieva k šíreniu AIDS. Výskyt HIV každoročne rastie. Podľa WHO bolo od roku 1980 do roku 2000 58 miliónov ľudí infikovaných HIV. Len v roku 2000 bolo na celom svete infikovaných 5,3 milióna ľudí a 3 milióny ľudí na AIDS zomreli. K 1. januáru 2004 bolo v Rusku registrovaných 264 tisíc ľudí infikovaných HIV. Polovica ľudí infikovaných HIV zomiera do 11 – 12 rokov od okamihu infekcie. Začiatkom roka 2004 žilo z každých 100 tisíc občanov Ruska približne 180 s diagnózou „HIV infekcia“. Predpokladá sa, že pri tejto úrovni chorobnosti bude celkový počet ľudí infikovaných HIV v Rusku do roku 2012 2,5 – 3 milióny ľudí. Zložitosť boja proti HIV infekcii závisí od viacerých dôvodov: po prvé, neexistujú účinné metódy jej liečby a špecifickej prevencie; po druhé, inkubačná doba HIV infekcie môže presiahnuť 10 rokov. Jeho trvanie závisí od okamihu aktivácie T-lymfocytu a DNA provírusu obsiahnutého v jeho chromozóme. Stále nie je jasné, či je každý, kto je nakazený vírusom, odsúdený na AIDS, alebo či je možné dlhodobé nosičstvo vírusu bez ochorenia (čo sa zdá nepravdepodobné). Nakoniec existuje niekoľko vírusov ľudskej imunodeficiencie (HIV-1, HIV-2), ktorých antigénne rozdiely bránia vzniku skríženej imunity. Objav vírusu opičej imunodeficiencie (SIV) objasnil otázku pôvodu HIV. SIV je podobný HIV svojou organizáciou genómu, ale výrazne sa líši svojou nukleotidovou sekvenciou. HIV-2 zaujíma medziľahlú polohu medzi HIV-1 a SIV svojimi sérologickými vlastnosťami a je k SIV bližší svojou nukleotidovou sekvenciou. V tejto súvislosti V. M. Ždanov naznačil, že vírusy HIV-1, HIV-2 a SIV pochádzajú zo spoločného predka. Podľa R. Galla je možné, že jeden zo SIV sa nejakým spôsobom dostal do ľudského tela, kde prešiel sériou mutácií, čo viedlo k vzniku HIV-1, HIV-2 a jeho ďalších foriem.
Príznaky HIV infekcie
Vírus ľudskej imunodeficiencie má niektoré vlastnosti, ktoré do značnej miery určujú patogenézu ochorenia. Vírus má veľmi vysokú mieru reprodukcie, ktorú určujú jeho regulačné prvky (v aktívnom štádiu sa syntetizuje až 5 000 viriónov za 5 minút). Vďaka prítomnosti fúzneho proteínu (gp41) vírus indukuje tvorbu rozsiahlych syncytiálnych štruktúr v dôsledku fúzie infikovaných a neinfikovaných T-helperov, čo vedie k ich hromadnej smrti. Molekuly proteínu gpl20, ktoré sa tvoria vo veľkom množstve, voľne cirkulujú v krvi a viažu sa na receptory neinfikovaných T-helperov, v dôsledku čoho ich tiež rozpoznávajú a ničia T-killery. Vírus sa môže šíriť medzibunkovými kanálmi z bunky do bunky, v takom prípade sa stáva ťažko dostupným pre protilátky.
Klinické kritériá pre HIV infekciu
U dospelých sa HIV infekcia diagnostikuje, ak majú aspoň dva závažné príznaky v kombinácii s aspoň jedným menej závažným príznakom a pri absencii iných známych príčin imunodeficiencie (rakovina, vrodená imunodeficiencia, silné hladovanie atď.). Medzi závažné príznaky patria:
- úbytok hmotnosti o 10 % alebo viac;
- dlhotrvajúci horúčkový stav, prerušovaný alebo konštantný;
- chronická hnačka.
Mierne príznaky: pretrvávajúci kašeľ, generalizovaná dermatitída, recidivujúci herpes zoster, orálna a faryngeálna kandidóza, chronický herpes simplex, generalizovaná lymfadenopatia. Diagnóza AIDS sa stanovuje iba v prítomnosti Kaposiho sarkómu, kryptokokovej meningitídy, pneumocystických zápalov pľúc. Klinický obraz ochorenia je ovplyvnený sprievodnou oportunistická infekciou.
Metódy kultivácie vírusu ľudskej imunitnej nedostatočnosti (HIV)
HIV-1 a HIV-2 sa môžu kultivovať v bunkách iba jedného klonu TCV4 lymfocytov - H9, získaného z leukemických TCV4 lymfocytov. Na tieto účely sa môžu použiť aj monovrstvové kultúry astrocytových buniek, v ktorých sa HIV-1 dobre reprodukuje. Medzi zvieratami sú na HIV-1 náchylné šimpanzy.
Rezistencia vírusu vo vonkajšom prostredí je nízka. Pod vplyvom slnečného žiarenia a UV žiarenia hynie, pri teplote 80 °C sa ničí do 30 minút, pri ošetrení bežne používanými dezinfekčnými prostriedkami do 20 – 30 minút. Na dezinfekciu materiálu obsahujúceho vírus je potrebné použiť mykobaktericídne dezinfekčné prostriedky, pretože sú účinné proti mikroorganizmom s najvyššou rezistenciou.
Laboratórna diagnostika HIV infekcie
Hlavnou metódou diagnostiky vírusonosičstva a HIV infekcie je enzýmový imunotest. Avšak vzhľadom na to, že gpl20 má štrukturálnu a antigénnu podobnosť s receptormi niektorých ľudských buniek, vrátane receptorov, ktoré transportujú imunoglobulíny cez epitelové bunky slizníc, sa v tele môžu objaviť protilátky súvisiace s protilátkami proti gpl20. V tomto prípade sa môžu vyskytnúť falošne pozitívne výsledky ELISA. Preto sa všetky pozitívne reagujúce séra subjektov podrobujú dodatočnej analýze pomocou imunoblottingovej metódy alebo Western blottingu. Táto metóda je založená na identifikácii skúmaných protilátok po ich elektroforetickej separácii a následnom testovaní pomocou značených anti-druhových protilátok. Virologická metóda sa používa zriedkavo kvôli zložitosti kultivácie vírusu. Klon lymfocytov H9 sa používa na získanie vírusových antigénov - nevyhnutných zložiek diagnostických testovacích systémov. Metóda CPR umožňuje detekciu vírusu v skorom štádiu virémie.
Liečba HIV infekcie
Je potrebné nájsť alebo syntetizovať lieky, ktoré účinne potláčajú aktivitu reverznej transkriptázy (revertázy) alebo vírusovej proteázy. Tieto by zabránili tvorbe DNA provírusu a/alebo inhibovali intracelulárnu reprodukciu vírusu. Moderná stratégia liečby HIV-infikovaných pacientov je založená na princípe kombinovaného použitia liekov, ktoré inhibujú vírusovú proteázu (jeden z liekov) a reverznú proteázu (2 rôzne lieky) - kombinovaná (trojitá) terapia. V Rusku sa na liečbu HIV-infikovaných pacientov odporúča kombinované použitie 2 domácich liekov: fosfazidu a krixivanu, ktoré špecificky potláčajú reprodukciu HIV v skorých a neskorých štádiách reprodukcie, najmä pri zníženej aktivite azidotymidínu.
Problémom špecifickej profylaxie je potreba vytvoriť vakcínu, ktorá by zabezpečila tvorbu účinnej bunkovo sprostredkovanej imunity založenej na vírusovo špecifických cytotoxických lymfocytoch bez akejkoľvek významnej produkcie protilátok. Takúto imunitu zabezpečujú Thl pomocné gény. Je možné, že protilátky, vrátane vírus neutralizujúcich, sú nielen neúčinné pri potláčaní HIV infekcie, ale na vysokej úrovni potláčajú bunkovo sprostredkovanú imunitu. Preto musí vakcína proti HIV spĺňať v prvom rade dve hlavné požiadavky: a) byť absolútne bezpečná a b) stimulovať aktivitu T-cytotoxických lymfocytov. Študuje sa účinnosť rôznych variantov vakcíny získaných z usmrtených (inaktivovaných) vírusov a z jednotlivých antigénov s vysokými ochrannými vlastnosťami. Takéto antigény je možné buď izolovať zo samotných viriónov, alebo chemicky syntetizovať. Bola navrhnutá vakcína vytvorená na základe metód genetického inžinierstva. Ide o rekombinantný vírus vakcínie nesúci gény HIV zodpovedné za syntézu antigénov so silnými imunogénnymi vlastnosťami. Otázka účinnosti týchto vakcín si vyžaduje značný čas kvôli dlhej inkubačnej dobe HIV infekcie a vysokej variabilite patogénu. Vytvorenie vysoko účinnej vakcíny proti HIV je naliehavým zásadným problémom.

