Lekársky expert článku
Nové publikácie
Besnota u detí
Posledná kontrola: 04.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Besnota alebo hydrofóbia je akútne vírusové ochorenie prenášané uhryznutím infikovaného zvieraťa, s poškodením nervového systému a rozvojom ťažkej encefalitídy s fatálnym koncom.
Epidemiológia
Vírus besnoty, ktorý je už od staroveku pohromou verejného zdravia, v súčasnosti spôsobuje približne 59 000 úmrtí ročne, pričom takmer všetky prípady sú prenášané uhryznutím psom. To má významný ekonomický dopad na rozvojové krajiny, najmä v Afrike a Ázii, ktoré znášajú najmenej takýchto strát. Napriek takmer 100 % úmrtnosti je však besnota psov úplne preventabilným ochorením a historické príklady eradikácie besnoty psov v rozvinutom svete to potvrdzujú. [ 1 ]
Príčiny besnota
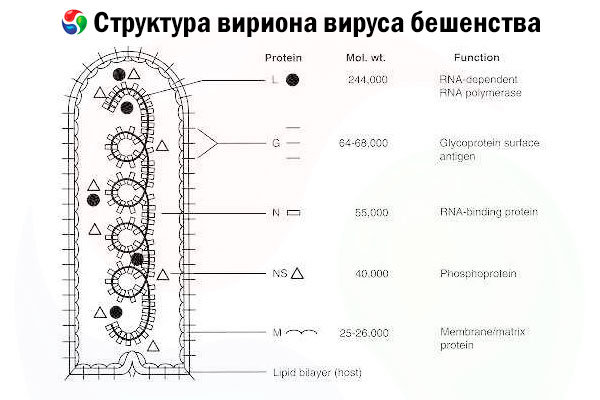
Pôvodcom je vírus besnoty (RV), vírus s negatívnym vláknom RNA z čeľade rabdovírusov, s rozmermi približne 60 nm × 180 nm.
Skladá sa z vnútorného proteínového jadra alebo nukleokapsidy, ktorá obsahuje nukleovú kyselinu, a vonkajšej membrány, dvojvrstvy obsahujúcej lipidy pokrytej transmembránovými glykoproteínovými hrotmi. Má relatívne jednoduchú modulárnu štruktúru genómu a kóduje päť štrukturálnych proteínov:
- RNA-dependentná RNA polymeráza (L),
- nukleoproteín (N),
- fosforylovaný proteín (P),
- matrixový proteín (M) a
- vonkajší povrchový glykoproteín (G).
Proteíny N, P a L spolu s genomickou RNA tvoria ribonukleoproteínový komplex. G je jediný antigén RV schopný indukovať produkciu protilátok neutralizujúcich RV, ktoré sú hlavnými imunitnými efektormi proti letálnej infekcii RV. Na druhej strane sa ukázalo, že ribonukleoproteínový komplex je hlavným antigénom RV schopným indukovať CD4+ T bunky, čo môže zvýšiť produkciu protilátok neutralizujúcich RV prostredníctvom intraštrukturálneho rozpoznávania antigénu.[ 2 ] Ribonukleoproteínový komplex môže zohrávať dôležitú úlohu pri vytváraní imunologickej pamäte a dlhodobej imunity.[ 3 ]
Klasifikácia a typy antigénov
Rod Lyssavirus zahŕňa vírus besnoty a antigénne a geneticky príbuzné vírusy besnoty: vírusy netopierov Lagos, Mokola a Duvenhage, ako aj dva predpokladané podtypy európskych lyssavírusov netopierov. Štúdie krížovej ochrany naznačujú, že zvieratá imunizované tradičnými vakcínami proti besnote nemusia byť úplne chránené pri vystavení sa iným lyssavírusom.
Vírusy besnoty možno klasifikovať ako fixné (adaptované pasážou v zvieratách alebo bunkovej kultúre) alebo pouličné (divoký typ). Použitie monoklonálnych protilátok a genetického sekvenovania na rozlíšenie pouličných vírusov besnoty pomohlo pri identifikácii vírusových variantov pochádzajúcich z hlavných hostiteľských rezervoárov na celom svete a pri navrhovaní pravdepodobných zdrojov expozície u ľudí, keď v prípade pacienta inak chýbala anamnéza definitívneho uhryznutia zvieraťom.[ 8 ]
Patogenézy
Hlavným rezervoárom a zdrojom infekcie medzi divými zvieratami sú vlky, líšky, šakaly, netopiere a medzi domácimi zvieratami - psy a mačky, zriedkavo - kone, dobytok, ošípané, potkany atď. Prenos infekcie z človeka na človeka je síce možný, ale extrémne zriedkavý. Ide o typickú zoonóznu infekciu. Ľudia sa nakazia besnotou hlavne od psov.
Po uhryznutí človeka chorým zvieraťom sa vírus rozmnoží vo svalovom tkanive v mieste uhryznutia a potom, po dosiahnutí koncov senzorických periférnych nervov, sa šíri centripetálne a dosahuje motorické neuróny. Čas potrebný na pohyb vírusu a postihnutie mozgu závisí od miesta uhryznutia. V prípade silného uhryznutia hlavy a tváre sa vírus môže dostať do centrálneho nervového systému za 15 – 20 dní a v prípade menšieho poškodenia kože trupu a končatín a následne malej dávky patogénu sa proces presunu vírusu do centrálneho nervového systému môže oneskoriť o niekoľko mesiacov alebo dokonca až o 1 – 1,5 roka. Po dosiahnutí centrálneho nervového systému sa vírus fixuje v tkanivách mozgu a miechy, najmä v neurónoch predĺženej miechy, Ammonovho rohu a mozgovej bázy. V mieche sú najviac postihnuté zadné rohy. Z centrálneho nervového systému sa vírus odstredivo pozdĺž nervových kmeňov dostáva do slinných žliaz, kde sa množí a vylučuje sa slinami.
Koncepty v patogenéze besnoty
RV má široké spektrum hostiteľov a môže infikovať takmer všetky cicavce. Hoci bolo hlásených niekoľko ciest prenosu RV, prirodzená infekcia sa najčastejšie vyskytuje uhryznutím. Okrem uhryznutia môže konzumácia tiel infikovaných RV podporiť infekciu vírusom besnoty u arktických líšok a kontakt RV so sliznicami sa ukázal ako ďalšia možná cesta prenosu.[ 9 ] Za niektorých nezvyčajných okolností, ako je náhodné uvoľnenie RV ako aerosólu v laboratóriu alebo RV ako aerosólu v jaskyniach obývaných veľkým počtom netopierov,[ 10 ] môže dôjsť k prenosu aerosólu.
Zatiaľ nie je jasné, či sa kmene RV z ulice a adaptované na myši alebo adaptované na tkanivové kultúry replikujú v mieste inokulácie predtým, ako vstúpia do CNS. Zatiaľ čo experimentálna intramuskulárna infekcia mladých škrečkov alebo mývalov pouličným RV odhalila replikáciu RV v bunkách priečne pruhovaného svalstva predtým, ako vírus napadol axóny motorických neurónov cez neuromuskulárne spojenia,[ 11 ],[ 12 ] intramuskulárna infekcia myší s RV CVS-24 adaptovaným na myši ukázala, že RV migruje priamo do CNS bez predchádzajúcej replikácie v mieste inokulácie.[ 13 ] Po dosiahnutí koncov nemyelinizovaných axónov sa RV retrográdne transportuje do tela bunky.
Nedávne zistenia naznačujú, že transport axónovými vezikulami môže predstavovať kľúčovú stratégiu pre pohyb viriónov na dlhé vzdialenosti v axónoch.[ 14 ] Odhaduje sa, že RV migruje v axónoch rýchlosťou 3 mm/h.[ 15 ] Infekcia sa potom šíri reťazcom neurónov spojených synaptickými spojmi. Presný mechanizmus, ktorý podporuje transsynaptické šírenie, však stále nie je známy. Po infikovaní mozgu sa vírus odstredivo šíri do periférneho a autonómneho nervového systému v mnohých periférnych orgánoch.[ 16 ] V poslednej fáze infekčného cyklu RV migruje do slinných žliaz; po replikácii v mukogénnych acinárnych bunkách sa uvoľňuje do slín a je pripravený na prenos na ďalšieho hostiteľa.[ 17 ]
Pokiaľ ide o patológiu vyvolanú vírusom besnoty, apoptotická bunková smrť bola navrhnutá ako potenciálny patogénny mechanizmus v experimentálnych modeloch besnoty u myší infikovaných fixným kmeňom RV.[ 18 ] Patogénnym mechanizmom, ktorý môže prispievať k hlbokej dysfunkcii CNS charakteristickej pre besnotu, môže byť zhoršená neuronálna funkcia. Ukázalo sa, že génová expresia je v neurónoch infikovaných RV výrazne znížená, čo vedie k celkovému potlačeniu syntézy bielkovín,[ 19 ] a niekoľko štúdií preukázalo zhoršenú neurotransmisiu po infekcii RV. Jiang preukázal, že väzba antagonistu acetylcholínového receptora na infikované homogenáty mozgu potkanov bola znížená v porovnaní s kontrolami.[ 20 ] V mozgu potkanov infikovaných RV sa pozorovalo aj zhoršené uvoľňovanie a väzba serotonínu, neurotransmiteru zapojeného do kontroly spánkového cyklu, vnímania bolesti a správania. [ 21 ], [ 22 ] Okrem ovplyvnenia neurotransmisie môže infekcia pravej komory ovplyvniť aj iónové kanály. Infikované myšie neuroblastómové bunky vykazujú zníženú funkčnú expresiu napäťovo riadených sodíkových kanálov, čo môže brániť akčným potenciálom a v konečnom dôsledku viesť k funkčnému poškodeniu. [ 23 ]
Okrem absencie závažných patologických lézií v CNS väčšina prípadov besnoty u ľudí nevyvoláva imunitnú odpoveď 7 až 10 dní po nástupe klinických príznakov. Tieto výrazné rozdiely medzi patogenézou besnoty a patogenézou väčšiny iných vírusových alebo bakteriálnych infekcií CNS sú ďalej podporené skutočnosťou, že imunosupresia je buď neúčinná, alebo škodlivá pre výsledok besnoty.[ 24 ] Nízka úroveň imunitnej odpovede často pozorovaná u obetí besnoty je záhadná, pretože ju nemožno vysvetliť slabou imunogenicitou antigénov RV. V skutočnosti sú RV G a nukleokapsidový proteín silnými antigénmi B- a T-buniek pri parenterálnom podávaní.[ 25 ] Možným vysvetlením nízkeho stupňa imunitnej odpovede proti RV u ľudí alebo zvierat s besnotou môže byť to, že RV infekcia CNS spôsobuje imunosupresiu [ 26 ] a bolo navrhnuté, že RV používa subverzívnu stratégiu vrátane prevencie apoptózy a ničenia inváznych T buniek. [ 27 ]
Oslabené kmene RV, ktoré boli adaptované na neneuronálne bunky, sa výrazne líšia od patogénnych kmeňov pouličného RV svojou neuroinvazívnosťou, ktorá sa vzťahuje na ich schopnosť preniknúť do CNS z periférnych miest. V tomto ohľade kmene RV adaptované na tkanivové kultúry buď nemajú, alebo majú len obmedzenú schopnosť preniknúť do CNS z periférnych miest, zatiaľ čo kmene pouličného RV alebo kmene RV adaptované na myši, ako napríklad CVS-24, sú vysoko invazívne.[ 28 ] Medzi kľúčové faktory zapojené do neuroinvázie RV patrí absorpcia vírusu, axonálny transport, transsynaptické šírenie a rýchlosť replikácie vírusu.
Až donedávna boli naše znalosti o patogenéze RV obmedzené a zakladali sa predovšetkým na deskriptívnych štúdiách kmeňov RV z ulice alebo experimentálnych infekcií s atenuovanými kmeňmi adaptovanými v laboratóriu. Príchod technológie reverznej genetiky nám umožnil identifikovať vírusové elementy, ktoré určujú patogénny fenotyp RV, a lepšie pochopiť mechanizmy zapojené do patogenézy besnoty.
Identifikácia vírusových elementov kontrolujúcich získavanie, šírenie a replikáciu vírusu besnoty
- Vírusové prvky zapojené do zachytávania vírusu
Infekcia RV začína pripojením vírusu k predpokladanému bunkovému receptoru. Hoci bolo ako RV receptory navrhnutých niekoľko molekúl na povrchu membrány, vrátane nikotínového acetylcholínového receptora,[ 29 ] molekuly adhézie nervových buniek[ 30 ] a nízkoafinitného neurotrofínového receptora p75 NTR,[ 31 ] stále nie je jasné, či tieto molekuly skutočne hrajú úlohu v životnom cykle vírusu besnoty. V tejto súvislosti sa nedávno ukázalo, že interakcia RV G–p75 NTR nie je potrebná na RV infekciu primárnych neurónov.[ 32 ] Po naviazaní na receptor sa RV internalizuje prostredníctvom adsorpčnej alebo receptorom sprostredkovanej endocytózy.[ 33 ] Prostredie s nízkym pH v endozomálnom kompartmente potom indukuje konformačné zmeny v RV G, ktoré spúšťajú fúziu vírusovej membrány s endozomálnou membránou, čím sa uvoľňuje RNP do cytoplazmy.[ 34 ] V prípade vírusov hrá RV G kľúčovú úlohu pri absorpcii vírusu, s najväčšou pravdepodobnosťou prostredníctvom interakcií s predpokladanými bunkovými receptormi, ktoré uľahčujú rýchle vychytávanie. V tomto ohľade sa preukázalo, že patogenita kmeňov RV adaptovaných na tkanivové kultúry (napr. ERA, HEP a CVS-11) koreluje s prítomnosťou determinantu umiestneného v antigénnom mieste III G proteínu. [ 35 ] Mutácia Arg → Gln v pozícii 333 v tomto antigénnom mieste G proteínu ERA viedla k sedemnásobnému oneskoreniu internalizácie variantu Gln333 RV v porovnaní s variantom divokého typu. Mutácia Asn194→Lys194 v RV G, ktorá vysvetľuje opätovný výskyt patogénneho fenotypu, bola spojená s významným skrátením času internalizácie.[ 36 ] Okrem toho experimenty s chimérickými RV ukázali, že čas potrebný na internalizáciu RV viriónov sa významne zvýšil a patogenita sa výrazne znížila po nahradení génu G vysoko patogénneho kmeňa SB RV, ktorý bol odvodený z cDNA klonu kmeňa RV-18 odvodeného zo striebra, asociovaného s netopiermi,[ 37 ] génom vysoko atenuovaného kmeňa SN, ktorý bol izolovaný z cDNA klonu vakcinačného kmeňa SAD B19 RV.[ 38 ] Tieto údaje spoločne podporujú myšlienku, že kinetika absorpcie vírusu, ktorá je funkciou RV G, je hlavným determinantom patogenity RV.
- Vírusové prvky zapojené do šírenia a prenosu vírusov
Jedinečnou vlastnosťou vírusu besnoty je jeho schopnosť šíriť sa z bunky do bunky. Pozorovanie, že variant Gln333 ERA stráca in vitro aktivitu bunkovej fúzie závislú od pH [ 39 ] a vykazuje výrazne zníženú schopnosť šíriť sa z bunky do bunky [ 40 ], naznačuje, že RV G tiež zohráva kľúčovú úlohu pri šírení z bunky do bunky, a teda aj pri prenose vírusu, pravdepodobne prostredníctvom svojej fúziogenetickej aktivity. Túto možnosť ďalej podporuje zistenie, že miera šírenia patogénneho revertantného RV SPBNGAK je takmer dvakrát vyššia ako miera stanovená pre nepatogénny variant SPBNGA. Je zaujímavé, že mutácia Asn 194 → Lys 194 v G SPBNGAK spôsobila posun prahu pH pre membránovú fúziu na vyššie pH, čo podporuje hypotézu, že vyšší prah pH pre membránovú fúziu je spojený so zvýšeným šírením vírusu. [ 41 ]
Štúdie transneuronálnych indikátorov infekcie RV u potkanov [ 42 ] a makakov rézus [ 43 ] ukázali, že vírus besnoty migruje výlučne retrográdnym smerom v axónoch. Hoci sa niekoľko proteínov RV podieľa na mechanizmoch neuronálneho transportu, zdá sa, že RV G zohráva dominantnú úlohu v transneuronálnom šírení infekcie RV. Napríklad, zatiaľ čo periférna infekcia vírusom infekčnej anémie koní (EIAV) pseudotypovaným s RV G vedie k prenosu vírusu do miechy, ten istý EIAV pseudotypovaný s vírusom vezikulárnej stomatitídy G sa nedostal do nervového systému. [ 44 ] Okrem toho sa zistilo, že šírenie vírusu mutanta ERA G Arg 333 → Gln 333 v CNS je v porovnaní s mutantom divokého typu výrazne znížené, čo ďalej naznačuje funkciu intaktného RV G v transsynaptickom šírení. Najpresvedčivejší dôkaz o dôležitej úlohe RV G v transsynaptickom transporte však pochádza z intrakraniálnej infekcie myší rekombinantným G-deficitným RV vírusom, ktorá ukázala, že infekcia zostala obmedzená na neuróny v mieste inokulácie bez akýchkoľvek dôkazov o šírení do sekundárnych neurónov.[ 45 ] Je však pravdepodobné, že okrem RV G zohráva úlohu v šírení vírusu, a teda aj v transsynaptickom transporte, aj RV M. V tejto súvislosti sa ukázalo, že šírenie chimérického variantu SN-BMBG RV, ktorý obsahuje M aj G z vysoko patogénneho SB, bolo výrazne vyššie ako šírenie chimérického variantu SN-BG alebo SN-BM, ktoré obsahujú G a M zo SB, čo naznačuje, že optimálna interakcia M s G môže hrať dôležitú úlohu pri šírení vírusu z bunky do bunky.[ 46 ] Keďže RV M podporuje pučanie vírusu,[ 47 ] je pravdepodobné, že efektívnejšie šírenie chimérického variantu RV SN-BMBG je spôsobené optimálnym pučaním vírusu na postsynaptickej membráne.
Nedávne štúdie ukázali, že interakcia medzi RV P a dyneínovým ľahkým reťazcom spája RV RNP s transportným systémom hostiteľskej bunky, čím uľahčuje retrográdny axonálny transport vírusu.[ 48 ],[ 49 ] Periférna infekcia dospelých myší však ukázala, že delécia väzbovej domény LC8 RV P nezabraňuje vstupu vírusu do CNS, čo naznačuje, že RV proteín nie je priamo zapojený do retrográdneho axonálneho šírenia RV.[ 50 ]
- Vírusové elementy, ktoré riadia replikáciu vírusu
Na rozdiel od mnohých iných vírusov, ako je napríklad vírus chrípky, je patogenita RV nepriamo úmerná rýchlosti syntézy vírusovej RNA a produkcii infekčných vírusových častíc. Porovnanie hladín vírusovej mRNA a genómovej RNA produkovanej rôznymi chimérickými vírusmi naznačuje, že transkripcia a replikácia vírusovej RNA sú regulované viacerými faktormi vrátane RV M, ktorý bol identifikovaný ako trans-pôsobiaci faktor, ktorý sprostredkováva prechod z počiatočných vysokých hladín syntézy mRNA na syntézu genómovej RNA.[ 51 ] Okrem toho, M zo všetkých rabdovírusov je schopný zastaviť expresiu vírusových génov väzbou na RNP, čo vedie k vytvoreniu vysoko kondenzovanej štruktúry podobnej hlavnému reťazcu, ktorá nie je schopná podporovať syntézu RNA.
Na identifikáciu ďalších vírusových elementov, ktoré kontrolujú patogenitu reguláciou vírusovej replikácie, boli 5' terminálne sekvencie vysoko patogénneho kmeňa SB postupne nahradené sekvenciami z vysoko atenuovaného vakcinačného kmeňa SN, čo viedlo k rekombinantným vírusom SB2 (terminálna sekvencia [TS] + L), SB3 (TS + L + pseudogén [Ψ]), SB4 (TS + L + Ψ + G) a SB5 (TS + L + Ψ + G + M). Intramuskulárna infekcia rodičovskými vírusmi SB a SN a chimérickými RV SB2, SB3, SB4 a SB5 vyvolala najvyššiu mieru úmrtnosti u myší infikovaných SB a žiadnu morbiditu ani mortalitu u myší infikovaných SN. Nahradenie TS, L a SB zodpovedajúcimi elementmi zo SN viedla k miernemu zníženiu morbidity a mortality a dodatočná výmena G alebo G plus M silne znížila alebo úplne zrušila vírusovú patogenitu.
Fenotypová charakterizácia týchto divokého typu a chimérických RV v tkanivovej kultúre odhalila, že patogenita daného RV je nepriamo úmerná jeho schopnosti replikovať sa v neuronálnych bunkách. Hoci sa SB replikoval na úrovniach takmer 1000-krát nižších ako SN a nahradenie TS, L a v SB hladinami SN malo malý vplyv na kinetiku rastu vírusu, dodatočná náhrada G alebo G plus M v SB zodpovedajúcimi génmi SN viedla k 1-logaritmickému zvýšeniu produkcie vírusu, čo naznačuje, že kinetika replikácie vírusovej RNA, ako aj produkcia vírusových častíc sú do značnej miery kontrolované proteínom G RV. Tento záver podporujú údaje získané s variantmi G RV, ktoré sa líšia o jednu aminokyselinu vo svojich proteínoch G. Patogénny variant vírusu besnoty SPBNGAK 194 produkoval v NA bunkách titer vírusu, ktorý bol o 1 log nižší ako titer produkovaný nepatogénnym variantom SPBNGAN 194, a analýza PCR v reálnom čase ukázala, že miera transkripcie a replikácie vírusovej RNA v NA bunkách infikovaných SPBNGAK bola 5- a 10-krát vyššia ako v NA bunkách infikovaných SPBNGAK.[ 52 ] Ďalší dôkaz inverznej korelácie medzi patogenitou a rýchlosťou syntézy vírusovej RNA a produkciou vírusových častíc poskytli myši infikované chimérickými rekombinantnými vírusmi, v ktorých boli gény G a M atenuovaného kmeňa SN nahradené génmi vysoko patogénneho kmeňa SB. Tieto experimenty odhalili významný nárast patogenity rodičovského kmeňa SN nesúceho RV G oproti patogénnemu kmeňu SB. Patogenita sa ďalej zvýšila, keď boli do SN zavedené G aj M zo SB.
Substitúcia G alebo M alebo oboch v SN zodpovedajúcimi génmi zo SB bola spojená s významným znížením rýchlosti produkcie vírusových častíc, ako aj rýchlosti syntézy vírusovej RNA. Tieto údaje naznačujú, že G aj M hrajú dôležitú úlohu v patogenéze RV reguláciou replikácie vírusu. Zistenie, že substitúcia G alebo G plus M v SN za G alebo G plus M zo SB vedie k miernemu až silnému zníženiu transkripcie a replikácie vírusovej RNA, zatiaľ čo substitúcia samotného M v SN za M zo SB vedie k silnému zvýšeniu transkripcie a replikácie vírusovej RNA, naznačuje, že RV G má tiež dôležitú regulačnú funkciu v transkripcii/replikácii vírusovej RNA, a to buď samostatne, alebo prostredníctvom interakcie s proteínom M. Mechanizmus, ktorým gén RV G riadi syntézu vírusovej RNA, nie je známy. Určité nukleotidové sekvencie v génoch RV G, ako napríklad tie, ktoré obsahujú kodóny pre Arg333 a Lys 194, boli identifikované ako ciele pre bunkové miRNA. Ukázalo sa, že rozpoznávanie cieľov bunkovými miRNA môže viesť k pozitívnej alebo negatívnej regulácii replikácie vírusu. [ 53 ] Substitúcie Arg 333 → Glu 333 alebo Lys 194 → Ser 194 v sekvencii génu RV G vedú k zrušeniu cieľových sekvencií miRNA, čo je následne spojené s významným zvýšením rýchlosti syntézy vírusovej RNA [Faber M, Thomas Jefferson University, PA, USA, nepublikované údaje], čo naznačuje, že miRNA hostiteľských buniek tiež zohrávajú dôležitú úlohu v regulácii replikácie RV, ako sa preukázalo u iných RNA vírusov vrátane vírusu vezikulárnej stomatitídy a HCV. [ 54 ], [ 55 ]
Regulácia replikácie vírusu sa javí ako jeden z dôležitých mechanizmov zapojených do patogenézy RV. Aby sa vyhli imunitnej odpovedi a zachovali integritu neurónovej siete, patogénne kmene RV, ale nie atenuované kmene, môžu regulovať svoju rýchlosť rastu. Nižšia rýchlosť replikácie pravdepodobne prospieva patogénnym kmeňom RV tým, že zachováva neuronálnu štruktúru, ktorú tieto vírusy používajú na dosiahnutie CNS. Ďalším vysvetlením nižšej rýchlosti replikácie patogénneho RV je, že aby sa vírus vyhol včasnej detekcii imunitným systémom hostiteľa, udržiava si minimálne hladiny expresie svojich antigénov.
Vzťah medzi expresiou RV G, apoptózou a patogenitou
Je dobre známe, že kmene vírusu pouličnej besnoty, ktoré sú výrazne patogénnejšie ako kmene adaptované na tkanivové kultúry, exprimujú veľmi obmedzené hladiny G a neindukujú apoptózu až do neskorej fázy infekčného cyklu, čo naznačuje, že patogenita konkrétneho vírusového kmeňa je nepriamo úmerná expresii RV G a schopnosti indukovať apoptózu.[ 56 ] Priamy dôkaz o korelácii medzi úrovňou expresie G a rozsahom apoptózy bol získaný s rekombinantným RV SPBNGA-GA, ktorý niesol dva identické gény G a nadmerne exprimoval RV G.[ 57 ] Morfologické štúdie neuronálnych kultúr infikovaných týmto rekombinantným RV ukázali, že bunková smrť bola významne zvýšená súbežne s nadmernou expresiou RV G a že apoptóza je hlavným mechanizmom zapojeným do smrti sprostredkovanej RV G. Najmä pokles farbenia F-aktínu po infekcii SPBNGA-GA je v súlade s apoptózou indukovanou depolymerizáciou aktínových filament. Okrem toho bol počet TUNEL-pozitívnych jadier v neurónoch infikovaných SPBNGA-GA významne zvýšený v porovnaní s neinfikovanými a SPBNGA-infikovanými neurónmi. Mechanizmus, ktorým gén RV G sprostredkováva proces apoptotickej signalizácie, však zostáva do značnej miery neznámy. Predpokladá sa, že expresia RV G nad určitou prahovou hodnotou vážne narúša bunkovú membránu. Je veľmi pravdepodobné, že apoptotické bunky nie sú v CNS rýchlo odstránené, a preto podliehajú sekundárnej nekróze. [ 58 ] Na druhej strane, infekcia RV a najmä nadmerná expresia proteínu RV G môže viesť k pyroptóze, dráhe bunkovej smrti podobnej apoptóze, ktorá na rozdiel od apoptózy zahŕňa aktiváciu kaspázy 1, a tým vedie k nekróze. [ 59 ] Stupeň nekrózy alebo pyroptózy vyvolanej infekciou RV pravdepodobne zohráva kľúčovú úlohu pri indukcii antivírusovej imunity. Zatiaľ čo apoptotické bunky si zachovávajú integritu svojej membrány a nestimulujú vrodenú imunitnú odpoveď, nekrotické bunky sa stávajú permeabilizovanými a vylučujú endogénne adjuvanty, ktoré môžu spustiť silnú vrodenú imunitnú odpoveď. [ 60 ]
Keďže úroveň apoptózy/nekrózy koreluje s imunogenicitou RV, predpokladá sa, že imunostimulačný účinok apoptotických/nekrotických buniek s najväčšou pravdepodobnosťou prispieva k vytvoreniu ochrannej imunitnej odpovede. Regulácia expresie RV G je preto s najväčšou pravdepodobnosťou dôležitým faktorom v patogenéze besnoty, pretože poskytuje prostriedky na prežitie a šírenie patogénnych variantov RV v nervovom systéme bez toho, aby spôsobila zjavné poškodenie neurónov a vyvolala ochrannú imunitnú odpoveď, ktorá by zabránila infekcii.
Expresia RV G môže byť regulovaná na úrovni syntézy RNA, na posttranslačnej úrovni alebo na oboch úrovniach. Ukázalo sa, že hladiny RV G exprimované rôznymi chimérickými variantmi RV sa odrážajú v rýchlosti syntézy vírusovej RNA, čo naznačuje, že rozdielna regulácia expresie RV G týmito variantmi vyplýva z variácií v rýchlosti transkripcie vírusovej mRNA. Rovnako ako pri rýchlosti transkripcie vírusovej RNA, množstvo RV G exprimované týmito variantmi nepriamo koreluje s patogenitou vírusu. Na druhej strane, infekcia primárnych neuronálnych kultúr menej patogénnym variantom RV CVS-B2c viedla k štvornásobne vyšším hladinám G proteínu ako infekcia vysoko patogénnym variantom CVS-N2c, a to aj napriek syntéze porovnateľných hladín G mRNA v oboch infekciách. Experimenty s pulzným chase ukázali, že vyššie hladiny G proteínu v neurónoch infikovaných CVS-B2c boli do značnej miery výsledkom nižšej rýchlosti degradácie G proteínu CVS-B2c v porovnaní s G proteínom CVS-N2c. Mechanizmus, ktorý vedie k rýchlejšej proteolytickej degradácii G proteínu CVS-N2c, však ešte nie je objasnený.
Príznaky besnota
Inkubačná doba besnoty je v priemere 30 – 90 dní. V prípade masívnej infekcie cez rozsiahle rany na hlave a tvári sa môže skrátiť na 12 dní. V zriedkavých prípadoch môže inkubačná doba trvať 1 rok alebo viac.
Existuje striktne postupná zmena troch období ochorenia: prodromálne, excitačné, paralýzové.
Prodromálne obdobie začína objavením sa bolesti alebo ťahania v mieste uhryznutia, ako aj bolesti pozdĺž nervov. V oblasti jazvy sa môže objaviť pocit pálenia, svrbenie, niekedy začervenanie a opuch. Pacient pociťuje celkovú malátnosť, bolesť hlavy, nevoľnosť. Zaznamenáva sa vracanie, zvýšenie telesnej teploty na 37,5-38 °C a príznaky progresívnej duševnej poruchy: zvýšená reflexná dráždivosť, nevysvetliteľný pocit úzkosti, strachu, melanchólie. Pacient je často depresívny, inhibovaný, uzavretý, odmieta jesť, zle spí, sťažuje sa na pochmúrne myšlienky, desivé sny. Prodromálne obdobie trvá 2-3 dni, niekedy sa predlžuje na 7 dní. Na konci tohto obdobia sa môžu vyskytnúť záchvaty úzkosti s krátkodobými ťažkosťami s dýchaním, pocitom tlaku na hrudníku, sprevádzané tachykardiou a zvýšenou frekvenciou dýchania.
Obdobie vzrušenia je poznačené výskytom hydrofóbie: pri pokuse o pitie a potom pri pohľade na vodu alebo pri jej pripomenutí pacient pociťuje kŕčovitý kŕč hltana a hrtana, počas ktorého s výkrikom odhodí hrnček s vodou, trasúcimi sa rukami vyhodí dopredu, zakloní hlavu a telo. Krk je natiahnutý, bolestivá grimasa skresľuje tvár, ktorá v dôsledku kŕča dýchacích svalov zmodraje. Oči vypúlia, prejavujú strach, prosia o pomoc, zreničky sú rozšírené, nádych je sťažený. Na vrchole záchvatu je možná zástava srdca a dýchania. Záchvat trvá niekoľko sekúnd, po ktorých sa stav pacienta zdanlivo zlepšuje. Následne sa môžu vyskytnúť záchvaty kŕčov svalov hrtana a hltana aj z pohybu vzduchu (aerofóbia), jasného svetla (fotofóbia) alebo hlasného slova (akustikofóbia). Záchvaty sú sprevádzané psychomotorickým nepokojom, počas ktorého sa pacient správa ako „blázon“. Vedomie je počas záchvatu zahmlené, ale v interiktálnom období sa vyjasní. Počas obdobia agitácie, v dôsledku zvýšeného tonusu sympatického nervového systému, u pacientov dochádza k prudkému zvýšeniu slinenia (sialorea) s neschopnosťou prehĺtať sliny v dôsledku kŕča faryngeálnych svalov. Pacient strieka sliny. U niektorých pacientov sa môžu vyvinúť príznaky meningizmu a dokonca opistotonusu, bežné sú kŕče. V tomto prípade sa mozgovomiechový mok nemusí meniť, ale u niektorých pacientov sa môže zvýšiť koncentrácia bielkovín a počet buniek sa môže zvýšiť v dôsledku lymfocytov.
Bez adekvátnej liečby sa stupňujú príznaky dehydratácie, črty tváre sa zaostrujú a telesná hmotnosť klesá. Telesná teplota stúpa na vysoké hodnoty. Možné sú kŕče. Trvanie excitačného štádia je približne 2-3 dni, zriedkavo 4-5 dní. Počas jedného z atakov zvyčajne dochádza k smrteľnému koncu. Zriedkavo pacient prežije do tretieho štádia ochorenia.
Počas obdobia paralýzy sa pacient upokojí. Záchvaty hydrofóbie ustúpia, pacient môže piť a prehĺtať jedlo, vedomie je jasné. Napriek zdanlivej pohode sa však čoskoro objaví letargia, apatia, depresia, paralýza končatín, panvové poruchy, paralýza hlavových nervov. Telesná teplota stúpne na 42 – 43 °C, arteriálny tlak klesá a do konca prvého dňa nastáva smrť v dôsledku paralýzy kardiovaskulárneho a dýchacieho centra.
V periférnej krvi sa pozoruje neutrofilná leukocytóza, zvýšený hemoglobín, erytrocyty a hematokrit.
Čo vás trápi?
Formuláre
Klinicky sa rozlišujú typické a atypické formy. Atypické formy zahŕňajú všetky prípady bez excitácie a hydrofóbie. Atypické formy zahŕňajú bulbárnu, cerebelárnu, meningoencefalitické atď.
Diagnostika besnota
Detekcia antigénu besnoty, protilátok, vírusovej RNA alebo izolácia vírusu umožňuje diagnostikovať besnotu. Keďže u pacienta s besnotou môže byť akýkoľvek individuálny test negatívny, niekedy sú potrebné sériové vzorky séra na detekciu protilátok proti besnote, vzorky slín na kultiváciu vírusu a biopsia kože na priame imunofluorescenčné testovanie vírusového antigénu, najmä ak existuje vysoké podozrenie na besnotu.
Jednou z najrýchlejších metód na diagnostikovanie besnoty pred smrťou u ľudí je vykonanie priameho imunofluorescenčného testu na biopsii kože z oblasti zátylku na detekciu antigénu besnoty. Priamy imunofluorescenčný test je najcitlivejšou a najšpecifickejšou metódou na detekciu antigénu besnoty v koži a iných čerstvých tkanivách (napr. biopsia mozgu), hoci výsledky môžu byť občas negatívne na začiatku ochorenia. Ak nie je k dispozícii čerstvé tkanivo, enzymatické štiepenie fixovaných tkanív môže zvýšiť reaktivitu imunofluorescenčného testu; citlivosť však môže byť neprijateľne nízka.
Diagnózu možno stanoviť aj izoláciou vírusu zo slín po inokulácii neuroblastómových buniek alebo laboratórnych hlodavcov; toto je zvyčajne najúčinnejšie počas prvých 2 – 3 týždňov ochorenia. Diagnostická je aj detekcia protilátok neutralizujúcich vírus besnoty, ktorá sa zvyčajne vykonáva pomocou rýchleho fluorescenčného fokusového inhibičného testu (RFFIT) v sére neočkovaných jedincov. Prítomnosť protilátok v mozgovomiechovom moku potvrdzuje diagnózu, ale môžu sa objaviť o 2 – 3 dni neskôr ako sérové protilátky, a preto môžu byť v skorých štádiách ochorenia menej užitočné. Zatiaľ čo sérologická odpoveď po očkovaní je vo všeobecnosti nerozoznateľná od sérologickej odpovede vyvolanej ochorením, očkovanie zvyčajne neprodukuje protilátky proti mozgovomiechovému moku.
Za posledných 25 rokov bolo dobre zdokumentovaných iba sedem prípadov „uzdravenia“ z besnoty. Hoci vírus besnoty nebol u žiadneho z pacientov izolovaný, vysoké titre protilátok neutralizujúcich besnotu vo vzorkách séra a prítomnosť neutralizačných protilátok v mozgovomiechovom moku silne podporili diagnózu.
Čo je potrebné preskúmať?
Aké testy sú potrebné?
Odlišná diagnóza
Diagnóza besnoty u ľudí sa zvyčajne stanovuje na základe epidemiologických a klinických údajov a potvrdzuje sa laboratórne. Diagnóza je jednoduchá, ak je v anamnéze uhryznutie zvieraťom a vyskytlo sa celé spektrum symptómov a prejavov. V opačnom prípade je pred vykonaním špecifických laboratórnych testov potrebné starostlivé, ale rýchle vyhodnotenie epidemiologických a klinických znakov menej typických prípadov. Každý pacient s neurologickými príznakmi alebo symptómami alebo nevysvetliteľnou encefalitídou by sa mal opýtať na možnosť kontaktu so zvieratami v oblastiach endemických pre besnotu v rámci krajiny pobytu alebo mimo nej. Neschopnosť podozrieť na besnotu pri niekoľkých nedávnych úmrtiach ľudí v Spojených štátoch mohla byť spôsobená nedostatočne starostlivou anamnézou kontaktu.
Na začiatku ochorenia môže besnota napodobňovať mnoho infekčných a neinfekčných ochorení. Mnohé ďalšie encefalitídy, ako napríklad tie, ktoré spôsobujú herpesvírusy a arbovírusy, sa podobajú besnote. Besnotu môžu napodobňovať aj iné infekčné choroby, ako napríklad tetanus, mozgová malária, rickettsióza a týfus. Medzi paralytické infekčné choroby, ktoré si možno zamieňať s besnotou, patrí detská obrna, botulizmus a herpes simian B encefalitída.
Medzi neinfekčné choroby, ktoré sa môžu zamieňať s besnotou, patrí množstvo neurologických syndrómov, najmä akútna zápalová polyneuropatia (Guillain-Barréov syndróm), ako aj alergická postvakcinačná encefalomyelitída sekundárna po očkovaní proti besnote nervového tkaniva, otrava alebo intoxikácia drogami, abstinenčné príznaky z alkoholu, akútna porfýria a hystéria z besnoty. Guillain-Barréov syndróm sa môže zamieňať s paralytickou besnotou a naopak.
Komu sa chcete obrátiť?
Liečba besnota
Liečba besnoty nebola vyvinutá. Podávanie veľkých dávok špecifického imunoglobulínu proti besnote a leukocytového interferónu je neúčinné. Na zmiernenie utrpenia pacienta sa podáva symptomatická liečba. Na tento účel sa pacient umiestni na samostatné oddelenie alebo box, vytvorí sa ochranný režim, ktorý obmedzuje vplyv vonkajšieho prostredia (znížený hluk, jasné svetlo, prúdenie vzduchu). Na zníženie dráždivosti centrálneho nervového systému sa predpisujú lieky na spanie, antikonvulzíva a lieky proti bolesti. Normalizuje sa vodná bilancia.
V paralytickom štádiu sa predpisujú lieky, ktoré stimulujú aktivitu kardiovaskulárneho a dýchacieho systému. Odporúča sa hyperbarická oxygenácia, mozgová hypotermia, kontrolované mechanické dýchanie s úplnou kurarizáciou pacienta. Všetky liečebné metódy sú však prakticky neúčinné. V najlepšom prípade je možné predĺžiť život pacienta o niekoľko mesiacov. Nepriaznivý výsledok je predurčený závažnosťou poškodenia mozgového kmeňa so zničením životne dôležitých centier.
Prevencia
Vývoj prvej vakcíny proti besnote Pasteurom v roku 1885 nastolil éru oveľa účinnejšej kontroly besnoty. Dnes, napriek takmer 100 % úmrtnosti ľudí na besnotu, je možné tomuto ochoreniu úplne predísť pre- a/alebo postexpozičným očkovaním. Zatiaľ čo Pasteur a jeho kolegovia iniciovali očkovanie súkromných psov v Paríži, prvé hromadné očkovanie psov sa uskutočnilo začiatkom 20. rokov 20. storočia v Japonsku, čo znamenalo prvý rozsiahly národný program kontroly besnoty. Orálna vakcinácia divých zvierat, ktorá bola prvýkrát vyvinutá v 70. rokoch 20. storočia, odvtedy opakovane preukázala účinnú kontrolu choroby u hlavných suchozemských hostiteľov, ako sú líšky, mývaly a skunky.[ 68 ] Dlhodobá vakcinácia populácií rezervoárových zvierat proti besnote s mierou pokrytia 70 % alebo vyššou nakoniec eliminuje RABV z rezervoárových druhov a zabráni šíreniu vírusu na náhodných hostiteľov.[ 69 ]
Fylogenetické údaje naznačujú, že lyssavírusy infikovali netopiere dávno predtým, ako infikovali suchozemské cicavce, a väčšina lyssavírusov vrátane RABV stále cirkuluje v rôznych druhoch netopierov po celom svete.[ 70 ] Účinné metódy na prevenciu prenosu RABV medzi netopiermi však zostávajú nejasné, čo v súčasnosti vylučuje možnosť úplnej eradikácie besnoty. Avšak aj po expozícii RABV uhryznutím cicavca infikovaného besnotou môže bezpečná a účinná postexpozičná profylaxia (PEP vrátane čistenia rán, imunoglobulínu proti besnote a očkovania proti besnote) chrániť ľudí pred infekciou besnotou, ak sa liečba podáva okamžite a v súlade s odporúčaniami Svetovej zdravotníckej organizácie (WHO).
Tieto dve metódy prevencie ľudských úmrtí – jedna založená na očkovaní exponovaných ľudí a druhá založená na očkovaní dostatočného počtu psov na prerušenie cyklu prenosu pri zdroji – sú základnými kameňmi prístupu „jedno zdravie“ k prevencii a kontrole besnoty u psov. Tieto dva rôzne spôsoby prevencie ľudských úmrtí boli posudzované ako samostatné alternatívy: stratégia A, založená na poskytovaní PEP ľuďom, a stratégia B, založená na očkovaní psov; alebo ako súčasti kombinovanej stratégie A + B v analýze pravdepodobných nákladov alternatívnych stratégií.[ 71 ]
Krajiny ako Thajsko dosiahli obrovský úspech v prevencii ľudských úmrtí pomocou PEP, ale zároveň zistili rastúci dopyt a súvisiace náklady spojené s používaním samotnej PEP. [ 72 ] Napríklad v porovnaní so situáciou v roku 1991 potrebovalo PEP v roku 2003 štyrikrát viac ľudí (viac ako 400 000). Nedávne údaje ukazujú, že Čínska ľudová republika, ktorá ročne očkuje 15 miliónov ľudí po potenciálnej expozícii besnote, vynakladá ročne približne 650 miliónov USD len na PEP. [ 73 ]
Oveľa udržateľnejším prístupom je predchádzať šíreniu infekcie pri zdroji, v populácii zvierat, a zároveň v prípade potreby zvýšiť prístup k PEP pre exponovaných ľudských pacientov. Tam, kde existuje politická vôľa a dostatočné financovanie na kontrolu besnoty psov, sa úmrtia môžu a aj boli eliminované. Rozšírené používanie očkovania psov viedlo k eliminácii besnoty psov vo viacerých krajinách vrátane Malajzie v roku 1954, [ 74 ] Japonska v roku 1956, Taiwanu v roku 1961, Singapuru a najmä v celej západnej Európe (prehľad v Rupprecht a kol., King a kol. a Gongal a Wright). [ 75 ]
Использованная литература


 [
[