Lekársky expert článku
Nové publikácie
Lieky
Lieky zabraňujúce trombóze a zlepšujúce reológiu krvi
Posledná kontrola: 07.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Pri prevencii tvorby viacerých mikrotrombov počas šoku a ich deštrukcii možno použiť rôzne farmakologické prístupy, ktoré využívajú lieky, ktoré zabraňujú tvorbe trombov a zlepšujú reológiu krvi:
- eliminácia systémových hemodynamických a mikrocirkulačných porúch pomocou vazoaktívnych a inotropných látok;
- opatrenia na zlepšenie reológie krvi pomocou racionálnej infúznej terapie a liekov, ktoré obnovujú elasticitu membrán erytrocytov (trental alebo pentoxifylín);
- prevencia agregácie krvných doštičiek a tvorby počiatočných „bielych“ trombov v malých arteriálnych cievach s následným spustením koagulačnej kaskády;
- inhibícia tvorby trombov po aktivácii systémovej koagulačnej kaskády;
- aktivácia fibrinolýzy s cieľom rozpustiť novovytvorené krvné zrazeniny (fibrinolyzín, streptokináza, streptodekáza, urokináza atď.) alebo naopak inhibícia fibrinolýzy, keď je u niektorých pacientov s traumatickým šokom a sepsou generalizovaná (kyselina aminokaprónová, ambén, kontrikal atď.).
Väčšina uvedených prístupov je tradičná, dobre rozvinutá v praxi liečby šoku, má svoje vlastné hemoreologické indikácie a je špecifikovaná v príslušných kapitolách. Preto je v tejto časti vhodné venovať sa úvahám o všeobecnom prístupe k prevencii tvorby trombov pri šoku pomocou farmakologických látok, ktoré ovplyvňujú profázu zrážania krvi. Práve táto úroveň prevencie koagulačných komplikácií - výskyt, tvorba a rast „bielych arteriálnych trombov“ - priťahuje najväčšiu pozornosť výskumníkov.
Pre rôzne typy šoku sú charakteristické rôzne a často viacsmerové poruchy zrážanlivosti krvi so zhoršením jej reológie. Najcharakteristickejším pre septický, endotoxínový, popáleninový, traumatický a hemoragický typ šoku je tvorba viacerých mikrotrombov v najmenších cievach, spôsobená poruchami systémovej hemodynamiky, vazospazmom a poruchami mikrocirkulácie, zahusťovaním krvi, kalom, zníženou elasticitou membrán erytrocytov, ako aj početnými všeobecnými a lokálnymi faktormi (autokoidy) iniciujúcimi lokálne zmeny v koagulačnej hemostáze a zahrnutím profázy zrážanlivosti krvi.
V schematickom (skrátenom) tvare je počiatočné štádium hemokoagulácie a mechanizmus lokálnej hemokoagulačnej homeostázy znázornený nasledovne.
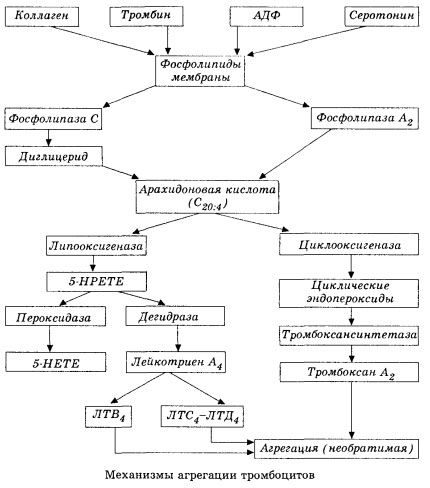
Začína sa aktiváciou membránovej fosfolipázy A2 v dôsledku pôsobenia kombinácie poškodzujúcich faktorov (priame poškodenie membrány, hypoxia, peroxidácia lipidov, pôsobenie endogénnych chemických faktorov atď.). V dôsledku rozpadu membránových fosfolipidov sa uvoľňujú neesterifikované mastné kyseliny s dlhým reťazcom, z ktorých najdôležitejšia je kyselina arachidónová ako východiskový substrát. Jej transformácia (kaskáda kyseliny arachidónovej) prebieha prostredníctvom lipoxygenázovej (syntéza leukotriénov) a cyklooxygenázovej (syntéza prostaglandínov, tromboxánov, prostacyklínu) dráhy.
Vzniknuté leukotriény (B4, C4, E4, D4 atď.) – látky s extrémne vysokou biologickou aktivitou, medzi ktoré patrí aj pomaly reagujúca látka anafylaxie – majú veľký význam pri iniciácii lokálnych cievnych, zápalových a imunitných reakcií vrátane autoimunitných procesov. Leukotriény spôsobujú poruchy mikrocirkulácie, zvýšenú zrážanlivosť krvi, uvoľňovanie autolytických lyzozomálnych enzýmov a uvoľňovanie faktora, ktorý inhibuje kontraktilitu myokardu a bronchiálny spazmus, do krvi.
Vďaka svojej schopnosti vyvolať kontrakciu hladkého svalstva leukotriény významne ovplyvňujú systémovú hemodynamiku, koronárne cievy a myokard, pričom majú silný koronárny konstriktor a negatívny inotropný účinok, ktorý je sprevádzaný znížením srdcového výdaja a hrá dôležitú úlohu pri rozvoji hypotenzie.
Znížený srdcový výdaj a hypotenzná reakcia na leukotriény sú spojené s oslabením srdcového svalu a obmedzením venózneho návratu do srdca. Významný význam pri obmedzovaní venózneho návratu má schopnosť leukotriénov zvýšiť permeabilitu cievnej steny a spôsobiť extravazáciu plazmy. Leukotriény sa považujú za dôležité v patogenéze infarktu myokardu.
Pri anafylaktickom a septickom (endotoxínovom) šoku sa ich úloha zjavne ešte viac zvyšuje, o čom svedčí schopnosť leukotriénov hromadiť sa vo významnom množstve v plazme počas alergických reakcií a spôsobovať zmeny systémového prietoku krvi charakteristické pre anafylaktický šok, ako aj ochranné účinky blokátorov leukotriénových receptorov a inhibítorov lipoxygenázy. Vývoj selektívnych blokátorov leukotriénových receptorov prebieha pomerne intenzívne a je sľubným smerom vedy. V tejto oblasti sa už dosiahli určité úspechy a účinnosť takýchto blokátorov pri ischémii myokardu, endotoxínovom a hemoragickom šoku bola experimentálne potvrdená. Pravdepodobne však bude trvať ešte niekoľko rokov, kým sa tento smer uplatní v klinickej praxi.
Ak sa v žilových cievach tromby tvoria za rovnakej účasti trombocytov a plazmatických koagulačných faktorov, potom v tepnách sú hlavnými iniciátormi procesu trombocyty. Obsahujú ADP, Ca2+, serotonín, fosfolipidy, enzýmy syntézy prostaglandínov a tromboxánu, trombostenín (podobne ako svalový aktomyozín zabezpečuje kontraktilnú schopnosť týchto buniek), trombogénny rastový faktor epitelu a svalových buniek cievnej steny a množstvo ďalších látok. Humorálna regulácia funkcií trombocytov sa vykonáva prostredníctvom špecializovaných receptorov ich membrán (alfa2- a beta2-adrenoreceptory, receptory pre histamín a serotonín, acetylcholín, tromboxán, adenozín a množstvo ďalších). Zvláštnou vlastnosťou trombocytov je vysoká afinita ku kolagénu a iným subendotelovým prvkom cievnej steny, k nezmáčavým a negatívne nabitým povrchom. Táto vlastnosť poskytuje trombocytom výnimočnú schopnosť priľnúť (prilepiť sa) k časti cievy s poškodeným endotelom, ktorá má počas šoku veľkú šancu na poškodenie. V tomto prípade sa trombocyty rozprestrú a uvoľnia pseudopódie, ktoré sa môžu prilepiť k sebe a k stene cievy. Permeabilita membrány sa zvyšuje a z trombocytov sa uvoľňujú ADP, serotonín, tromboxán a niektoré koagulačné faktory adsorbované na povrchu trombocytu. Tieto látky interagujú s príslušnými receptormi na membráne a za účasti iónov vápnika spôsobujú agregáciu (spočiatku reverzibilnú). Proces sa stáva samoudržateľným, čo je uľahčené humorálnymi regulačnými faktormi; iné faktory ho naopak môžu zastaviť a dokonca zvrátiť, čo spôsobuje disagregáciu.
S prevahou vplyvov a podmienok tvoriacich tromby sú fázy adhézie a reverzibilnej agregácie nahradené treťou fázou - ireverzibilnou agregáciou, ktorá sa vykonáva za účasti trombostenínu a vedie k zúženiu zrazeniny; reakcia posilnenia agregátora a zúženia prebieha aj za účasti Ca+, ATP a vedie k tvorbe bieleho trombu.
Cyklooxygenázová dráha premeny kyseliny arachidónovej v krvných doštičkách, cievnych endotelových bunkách a iných tkanivách zaisťuje lokálnu (polčas rozpadu metabolitov je veľmi krátky) koagulačnú homeostázu, pretože počas tohto metabolizmu sa tvoria silné pro- a antiagregačné látky. Hlavným faktorom aktivujúcim agregáciu krvných doštičiek v cyklooxygenázovom reťazci reakcií je tromboxán A2 a jeho nemenej silným antagonistom je prostacyklín, produkovaný endotelovými bunkami a v menšej miere prostaglandínmi série E a G. Agregáciu krvných doštičiek nakoniec silne ovplyvňujú aj ďalšie lokálne a systémové humorálne faktory.
Aktivátory a inhibítory agregácie krvných doštičiek
Iniciátory a aktivátory agregácie krvných doštičiek |
Inhibítory agregácie krvných doštičiek |
Kolagén |
- |
ADP |
Adenozín a jeho stabilizátory |
Norepinefrín (prostredníctvom alfa2 receptorov) |
Alfa-adrenergné blokátory |
Serotonín |
Antiserotonínové látky |
Histamín |
Antihistaminiká |
Trombín |
Heparín |
Ca2+ |
Antagonisty Ca2+ |
CGMP - jeho induktory (acetylcholín?) a stabilizátory |
CAM - jej induktory (prostredníctvom beta-adrenergných receptorov) a stabilizátory (inhibítory fosfodiesterázy) |
Kyselina arachidónová |
Dextrany, albumín |
Tromboxán A2 |
Prostacyklín I2 |
Farmakologické intervencie v počiatočnej fáze tvorby trombu pri šoku a akútnych ischemických procesoch v srdci a mozgu naznačujú nasledujúcu možnosť:
- inhibícia počiatočných reakcií (celkových a čiastočných) kaskády kyseliny arachidónovej;
- inhibícia špecifickej reakcie syntézy tromboxánu;
- blokáda receptorov pre leukotriény a tromboxány v krvných doštičkách, hladkom svalstve a iných bunkách;
- použitie látok, ktoré modulujú agregáciu krvných doštičiek, t. j. inými spôsobmi oslabujú ich reakciu na vplyv iniciačných faktorov (kolagén, tromboxán A2, leukotriény atď.).
Implementácia uvedených spôsobov korekcie porúch reologických vlastností krvi umožňuje riešenie hlavnej taktickej úlohy: chrániť receptory agregácie a adhézie krvných doštičiek pred účinkom aktivátorov alebo potlačiť intracelulárne mechanizmy syntézy týchto receptorov. Inhibícia počiatočných reakcií kaskády kyseliny arachidónovej sa môže dosiahnuť ochranou receptorov krvných doštičiek, ktoré reagujú na polymérne aktivátory, pomocou nízkomolekulárnych dextránov, ktorých molekuly súťažia s fibrínom, kolagénom, agregovaným imunoglobulínom (IgE) a zložkami komplementového systému.
Nízkomolekulárne dextrány maskujú receptory na membráne krvných doštičiek a súťažia s proteínmi s veľkou disperziou na povrchu erytrocytov, čím ich vytláčajú a ničia mostíky medzi bunkami. Je to spôsobené tým, že dextrány, ktoré obaľujú cievny endotel a povrch krvných bunkových elementov, zvyšujú ich negatívny náboj, čím zvyšujú antiagregačné vlastnosti.
Dextrany
Nízkomolekulárne dextrány znižujú agregáciu krvných doštičiek indukovanú kolagénom a ADP, ako aj aktivačný účinok trombínu na krvné doštičky, inhibujú rast počiatočného trombu bielych krvných doštičiek, zlepšujú prietok krvi, znižujú pooperačný nárast obsahu fibrinogénu v plazme a menia štruktúru a stabilitu fibrínu.
Intravenózne infúzie dextránov pri traume a šoku nielen znižujú agregáciu a adhéziu krvných doštičiek, ale aj mobilizujú endogénny heparín, čím podporujú tvorbu voľnej a ťažko stiahnuteľnej krvnej zrazeniny, ktorú fibrinolytiká ľahko lyzujú. Antitrombínová aktivita nízkomolekulárnych dextránov je spojená s ich špecifickým účinkom na štruktúru a funkciu faktora koagulácie krvi VIII. Faktor VIII (antihemofilný globulín), veľká molekula so zložitou štruktúrou a funkciou, sa podieľa na agregácii krvných doštičiek a stabilite výslednej zrazeniny. Dextrány interferujú s účinkom faktora VIII, čím spomaľujú agregáciu krvných doštičiek a znižujú stabilitu zrazeniny.
Nízkomolekulárne dextrány nie sú pravými antikoagulanciami a ich korekčný účinok pri hemoreologických poruchách je spojený najmä s hemodilúciou, doplnením objemu cirkulujúcej plazmy a zlepšením prietoku krvi v mikrocirkulačnom systéme.
Schopnosť dextránov zlepšiť prietok krvi pri hemodynamických poruchách (šok, strata krvi) je spôsobená komplexom faktorov. Výskyt vysokej prechodnej koncentrácie polyméru v krvi vedie nielen k „priamej hemodilúcii“, ale vytvára aj podmienky pre tok tekutiny do krvného obehu z intersticiálneho priestoru a následné vyrovnanie osmotického účinku dextránu. V dôsledku hemodilúcie sa znižuje viskozita krvi, zvyšuje sa venózny prítok do srdca a zvyšuje sa srdcový výdaj. Spolu s týmito účinkami dextrán tvorí komplexy s fibrinogénom a má antilipemický účinok.
Antiagregačný účinok a hemodynamické účinky nízkomolekulárnych dextránov teda pomáhajú znižovať viskozitu krvi, čo je obzvlášť dôležité pri nízkych šmykových rýchlostiach. Disagregácia krvných buniek zlepšuje systémový prietok krvi a mikrocirkuláciu, najmä v jej venóznej časti, kde sú gradienty rýchlosti najnižšie. Použitie roztokov nízkomolekulárnych dextránov pri rôznych typoch šoku, počas chirurgickej liečby poranení a ich následkov a potom v pooperačnom období pomáha predchádzať hyperkoagulácii a znižovať pravdepodobnosť trombotických procesov a embólie.
Treba však poznamenať, že v niektorých prípadoch sú infúzie dextránových roztokov sprevádzané anafylaktickými a alergickými reakciami (nebezpečné v prípade senzibilizácie a anafylaktického šoku). Je to spôsobené tým, že dextrány, ktoré majú veľkú molekulovú hmotnosť a veľa bočných reťazcov, môžu pôsobiť ako antigén. Preto sa na stanovenie individuálnej citlivosti odporúča predbežne podať intravenózne až 20 ml nízkomolekulárneho roztoku dextránu ako haptén (15 % roztok, molekulová hmotnosť 1000) a pred zavedením anestézie vykonať infúzie plazmatickej náhrady.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Inhibítory trombínu
Farmakologickú ochranu receptorov krvných doštičiek interagujúcich s aktivátormi krvných doštičiek možno dosiahnuť aj pomocou látok, ktoré súťažia s nepolymérnymi aktivátormi krvných doštičiek alebo ich inhibujú. Medzi takéto látky patria inhibítory trombínu (heparín a hirudín, množstvo syntetických inhibítorov, antagonisty adrenalínu), blokátory alfa-receptorov (fentolamín, dihydroergotamín), antagonisty ADP (dipyridamol, adenozín a jeho štrukturálne analógy, fosfokreatín), antagonisty serotonínu (metysergid). Len niekoľko z uvedených látok sa v skutočnosti používa na prevenciu a liečbu šoku rôzneho pôvodu.
Ochrana intracelulárnych mechanizmov syntézy proteínových receptorov, ktoré reagujú s aktivátormi agregácie a adhézie krvných doštičiek, a inhibícia procesov syntézy tromboxánu sú možné pomocou liekov rôznych skupín:
- induktory a stabilizátory cATP, prostacyklínu a prostaglandínu PgE2;
- inhibítory fosfolipázy a fosfodiesterázy.
Intenzívny vývoj špeciálnych antiagregačných látok sa začal relatívne nedávno a zatiaľ neviedol k spoľahlivým výsledkom. V súčasnosti sa v klinickej praxi okrem dextránových roztokov na prevenciu tvorby bielych krvných doštičiek široko používajú aj antiagregačné látky, ako je kyselina acetylsalicylová, indometacín, dipyradamol, sulfínpyrazón (persantín), prostacyklín (eikoprostenón) a heparín.
Nesteroidné protizápalové lieky
Bolo zistené, že farmakologické účinky nesteroidných protizápalových liekov - kyseliny acetylsalicylovej a indometacínu - sú spôsobené ich vplyvom na metabolizmus eikosanoidov (tromboxánov a prostaglandínov). Takmer všetky lieky v tejto skupine inhibujú enzýmový komplex známy ako prostaglandínsyntetáza, čím vyvíjajú svoje špecifické a antiagregačné účinky.
Kyselina acetylsalicylová sa po perorálnom podaní veľmi rýchlo vstrebáva. Produkt jej hydrolýzy, kyselina salicylová, spôsobuje inhibíciu cyklooxygenázy krvných doštičiek, čo narúša premenu kyseliny arachidónovej na prostaglandín O2 a nakoniec tromboxán A2. Kyselina acetylsalicylová inhibuje agregáciu indukovanú kolagénom, ADP, adrenalínom a serotonínom. Hoci jej GG05 je 15 minút, antiagregačný účinok pretrváva niekoľko dní, čo sa zrejme vysvetľuje ireverzibilnou inhibíciou reakcií syntézy prostaglandínov a potlačením funkcie agregácie krvných doštičiek počas celej ich životnosti (6-10 dní). Spolu s inhibíciou cyklooxygenázy krvných doštičiek kyselina acetylsalicylová vo vysokých dávkach inhibuje cyklooxygenázu cievnej steny a súčasne s potlačením syntézy tromboxánu A2 inhibuje syntézu prostacyklínu v endotelových bunkách. Preto by sa kyselina acetylsalicylová mala predpisovať ako antiagregačný prostriedok v malých dávkach (3000-5000 mg/deň), ktoré prevažne inhibujú agregáciu krvných doštičiek.
Vzhľadom na to, že kyselina acetylsalicylová blokuje cyklooxygenázu krvných doštičiek niekoľko dní a endotelovú cyklooxygenázu nie viac ako jeden deň, je racionálne predpisovať liek nie denne, ale každé 3-4 dni. Výber optimálnej dávky kyseliny acetylsalicylovej pre pacienta by sa mal vykonávať individuálne, pretože citlivosť pacientov na antiagregačný účinok lieku je rôzna. U reaktívnych pacientov kyselina acetylsalicylová v dávke 0,5 g inhibuje agregáciu krvných doštičiek o 40-50%, u hyperreaktívnych pacientov úplne alebo o 80-90% a u reaktívnych pacientov je charakteristická absencia antiagregačného účinku pri užívaní rovnakej dávky lieku.
Selektívne inhibítory tromboxánsyntetázy sú imidazol a jeho analógy, ktoré neblokujú cyklooxygenázu. Dipyridamol, používaný v klinickej praxi pri liečbe chronickej ischemickej choroby srdca ako koronárny dilatátor, podobne ako imidazol selektívne inhibuje tromboxánsyntetázu, čím zabraňuje syntéze tromboxánu A2. Predpokladá sa, že liek a jeho analógy tiež inhibujú krvnú fosfodiesterázu, čím zvyšujú koncentráciu cAMP v krvných doštičkách. Spolu s tým dipyridamol inhibuje aktivitu adenozíndeaminázy a vychytávanie adenozínu krvnými doštičkami, blokuje absorpciu serotonínu krvnými doštičkami a ich agregáciu indukovanú adrenalínom a kolagénom. Existujú správy o slabej antiagregačnej aktivite lieku a jeho schopnosti v malých dávkach zvyšovať agregáciu krvných doštičiek. Najspoľahlivejší antiagregačný účinok sa dá dosiahnuť kombináciou dipyridamolu a kyseliny acetylsalicylovej.
Heparín
Medzi antitrombotickými látkami je jedným z najúčinnejších regulátorov agregátneho stavu krvi heparín, najmä pri skorom použití. Heparín má vysoký negatívny náboj a je schopný interagovať s veľkými aj malými iónmi a molekulami (enzýmy, hormóny, biogénne amíny, plazmatické proteíny atď.), takže spektrum jeho biologického účinku je pomerne široké. Liek má antitrombínové, antitromboplastínové a antiprotrombínové účinky, zabraňuje premene fibrinogénu na fibrín, potláča retrakciu zrazeniny a zvyšuje fibrinolýzu.
Mechanizmus antikoagulačného účinku heparínu je pomerne zložitý. V súčasnosti sa zistilo, že antikoagulačné účinky heparínu sú spojené so zosilnením účinku antitrombínu III a zvýšením schopnosti komplexu heparín-antitrombín III rýchlo inaktivovať väčšinu serínových proteáz systému zrážania krvi. V antitrombotickom účinku heparínu má veľký význam jeho schopnosť zvyšovať a udržiavať vysoký elektronegatívny potenciál cievnej intimy, čím zabraňuje adhézii krvných doštičiek a tvorbe krvných mikrotrombov. Heparín najaktívnejšie potláča tvorbu trombov v žilách, čím zabraňuje lokálnej tvorbe trombov aj diseminovanej intravaskulárnej koagulácii.
Prostacyklín a jeho stabilné analógy
Medzi antiagregačnými látkami sú najsilnejšími inhibítormi agregácie prostacyklín a jeho stabilné analógy. Antiagregačný účinok prostacyklínu je spôsobený stimuláciou adenylátcyklázy a v dôsledku toho zvýšením koncentrácie cAMP v krvných doštičkách, znížením obsahu tromboxánu, znížením obsahu tromboxánu A2 a blokádou jeho receptorov. Prostacyklín je nestabilný a rýchlo sa hydrolyzuje na neaktívne produkty, preto sa podáva intravenózne kvapkovo rýchlosťou 2 až 20 ng/kg za minútu počas 30-60 minút až 6-krát denne.
Prostacyklín má spolu so silným antiagregačným účinkom aj silný vazodilatačný a bronchodilatačný účinok. Liek rozširuje cievy mozgu, srdca, obličiek, kostrových svalov a mezenterických ciev. Pod vplyvom prostacyklínu sa zvyšuje koronárny prietok krvi, zvyšuje sa energetické zásobenie myokardu a znižuje sa jeho potreba kyslíka. Napriek jeho nestabilite v tele môžu klinicky priaznivé účinky pretrvávať niekoľko týždňov a dokonca mesiacov. Mechanizmus takéhoto predĺženého účinku ešte nie je jasný.
Prostacyklín je nízkotoxický liek, ale jeho užívanie môže spôsobiť vedľajšie účinky: sčervenanie tváre, bolesti hlavy, znížený krvný tlak, bolesti brucha, anorexia. Spolu s prostacyklínom sú jeho syntetické stabilné analógy (iloprost atď.) sľubnými inhibítormi agregácie krvných doštičiek.
Lieky, ktoré zlepšujú viskozitu krvi
Poruchy reologických vlastností krvi počas traumy a šoku sú spôsobené nielen zmenami funkčnej aktivity krvných doštičiek, ale aj zvýšením viskozity krvi. Štrukturálna viskozita krvi ako komplexného dynamického dispergovaného systému je do značnej miery určená viskozitou plazmy a schopnosťou erytrocytov deformovať sa. Viskozita plazmy závisí hlavne od koncentrácie bielkovín v krvi. Bielkoviny s malou molekulovou hmotnosťou, ako je albumín, majú malý vplyv na viskozitu plazmy, zatiaľ čo bielkoviny s veľkou molekulou (fibrinogén, alfa- a gama-globulíny, iné makromolekuly) ju výrazne zvyšujú.
Pri nízkych šmykových rýchlostiach vedie adsorpcia fibrinogénu a globulínov na povrchu erytrocytov k tvorbe mostíkov medzi susednými bunkami a tvorbe agregátov z erytrocytov. Rýchlosť tvorby agregátov je zložitý biofyzikálny proces a závisí nielen od veľkosti šmyku, ale aj od elektrokinetických vlastností erytrocytov, koncentrácie, hmotnosti a sorpčnej kapacity makromolekúl-agregátorov, od tvaru a plasticity erytrocytov.
Udržiavanie tvaru a mechanických vlastností membrány erytrocytov si vyžaduje značný výdaj energie. Predpokladá sa, že energia produkovaná v erytrocytoch počas glykolýzy sa vynakladá na fosforyláciu spektrínu, čo má za následok zmeny v sekundárnej štruktúre proteínu a interakciu so susednými zložkami vnútornej membrány. Interakcia medzi štrukturálnymi proteínmi membrány, spektrínom a aktínom, hrá dôležitú úlohu pri formovaní mechanických vlastností membrány erytrocytov, pri udržiavaní konštantného povrchu erytrocytu a jeho hrúbky pri akejkoľvek deformácii.
Pri systémových hemodynamických a orgánových poruchách prekrvenia vedie zvýšenie rigidity erytrocytových membrán a tvorba erytrocytových agregátov k zníženiu rýchlosti prechodu erytrocytov kapilárami, čím sa narúša funkcia prenosu plynov krvou. Preto by korekcia porúch reologických vlastností krvi v šoku mala zahŕňať okrem prevencie agregácie erytrocytov aj normalizáciu viskozity plazmy a krvi, agregácie a deformácie erytrocytov.
Okrem nízkomolekulárnych dextránov sú roztoky albumínu jedným z účinných prostriedkov na zvýšenie stability krvnej suspenzie. V neskorom období šoku dochádza k generalizovanej agregácii erytrocytov na pozadí poklesu koncentrácie albumínu v krvnej plazme a zvýšenia koncentrácie fibrinogénu a globulínov, najmä alfa2 frakcie, lipoproteínov a lipidov. Za týchto podmienok sú reologické účinky albumínu spôsobené dvoma hlavnými faktormi: hemodilúciou a normalizáciou pomeru medzi mikro- a makroglobulárnymi proteínmi v plazme. Zároveň albumín viaže voľné kyseliny, ktorých labilizácia počas traumy a šoku stimuluje agregáciu bunkových štruktúr krvi a intravaskulárnu koaguláciu a môže spôsobiť tukovú embóliu.
Protišokové opatrenia zamerané na doplnenie objemu cirkulujúcej krvi, elimináciu tkanivovej hypoxie a metabolickej acidózy prispievajú k normalizácii elasticity erytrocytových membrán, pretože hypoxia a acidóza významne znižujú deformovateľnosť erytrocytov. Zvýšená rigidita erytrocytových membrán v šoku je pravdepodobne spojená s inhibíciou syntézy ATP v erytrocytoch. Zníženie koncentrácie ATP zase prispieva k zvýšeniu koncentrácie Ca2+ v erytrocytoch, ktorý väzbou na membránové proteíny zvyšuje rigiditu membrány.
Jedným z farmakologických liekov, ktoré zvyšujú obsah ATP v erytrocytoch a elasticitu membrán erytrocytov, je Trental (pentoxifylín), ktorý sa v klinickej praxi používa na liečbu ischemických porúch.
Spolu so znížením rigidity membrán erytrocytov spôsobuje Trental vazodilatáciu, zlepšuje okysličenie tkanív, inhibuje aktivitu fosfodiesterázy v tkanivách, zvyšuje koncentráciu cAMP a inhibuje agregáciu krvných doštičiek.
Z ďalších farmakologických látok, ktoré udržiavajú elasticitu membrány erytrocytov, stojí za zmienku antagonisty Ca2+, ktoré obmedzujú tok iónov do erytrocytov (flunarizín, nifedipín atď.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Pozor!
Na zjednodušenie vnímania informácií boli tieto pokyny na používanie lieku "Lieky zabraňujúce trombóze a zlepšujúce reológiu krvi" preložené a predložené v špeciálnom formulári na základe oficiálnych pokynov na lekárske použitie lieku. Pred použitím si prečítajte anotáciu, ktorá prišla priamo k lieku.
Popis je poskytovaný na informačné účely a nie je návodom na seba-liečenie. Potreba tohto liečiva, účel liečebného režimu, spôsobov a dávky liečiva určuje výlučne ošetrujúci lekár. Samoliečenie je pre vaše zdravie nebezpečné.

