Lekársky expert článku
Nové publikácie
Prištítne telieska
Posledná kontrola: 04.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
V roku 1879 švédsky vedec S. Sandstrom opísal prištítne telieska u ľudí a dal im názov. Prištítne telieska sú životne dôležité orgány. Ich funkciou je produkovať a vylučovať parathormón (PTH), jeden z hlavných regulátorov metabolizmu vápnika a fosforu.
Párová horná prištítna telieska (glandula parathyroidea superior) a dolná prištítna telieska (glandula parathyroidea inferior) sú okrúhle alebo vajcovité telieska umiestnené na zadnej strane každého z lalokov štítnej žľazy: jedna žľaza hore, druhá dole. Dĺžka každej žľazy je 4-8 mm, šírka je 3-4 mm, hrúbka je 2-3 mm. Počet týchto žliaz nie je konštantný a môže sa pohybovať od 2 do 7-8, v priemere sú štyri. Celková hmotnosť žliaz je v priemere 1,18 g.
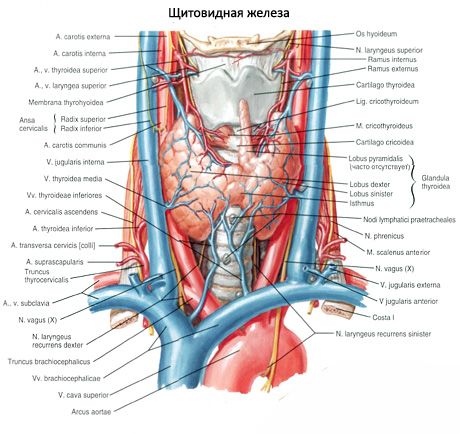
Prištítne telieska sa od štítnej žľazy líšia svetlejšou farbou (u detí sú bledoružové, u dospelých žltohnedé). Prištítne telieska sa často nachádzajú v mieste prenikania dolných štítnych tepien alebo ich vetiev do tkaniva štítnej žľazy. Prištítne telieska sú od okolitých tkanív oddelené vlastným vláknitým puzdrom, z ktorého do žliaz vystupujú vrstvy spojivového tkaniva. Tieto obsahujú veľké množstvo ciev a delia prištítne telieska na skupiny epitelových buniek.
Parenchým žliaz je tvorený hlavnými a acidofilnými paratyrocytmi, ktoré tvoria šnúry a zhluky obklopené tenkými zväzkami vlákien spojivového tkaniva. Oba typy buniek sa považujú za rôzne štádiá vývoja paratyrocytov. Hlavné paratyrocyty majú polyedrický tvar, bazofilnú cytoplazmu s veľkým počtom ribozómov. Medzi týmito bunkami sa rozlišujú tmavé (aktívne sekretujúce) a svetlé (menej aktívne). Acidofilné paratyrocyty sú veľké, s jasnými kontúrami, obsahujú veľa malých mitochondrií s časticami glykogénu.
Hormón prištítnych teliesok, paratyroxín (parathormón), má bielkovinové zloženie a podieľa sa na regulácii metabolizmu fosforu a vápnika. Parathormón znižuje vylučovanie vápnika močom a zvyšuje jeho vstrebávanie v čreve v prítomnosti vitamínu D. Tyreokalcitonín je antagonista parathormónu.
Embryogenéza prištítnych teliesok
Prištítne telieska sa vyvíjajú z epitelu párových žiabrových vreciek III a IV. V 7. týždni vývoja sa epitelové zárodky tiel oddeľujú od stien žiabrových vreciek a v procese rastu sa pohybujú kaudálnym smerom. Následne sa formujúce prištítne telieska usadia na zadných plochách pravého a ľavého laloku štítnej žľazy.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
Cievy a nervy prištítnych teliesok
Krvné zásobenie prištítnych teliesok zabezpečujú vetvy hornej a dolnej štítnej žľazy, ako aj pažerákové a tracheálne vetvy. Žilová krv odteká rovnomennými žilami. Inervácia prištítnych teliesok je podobná inervácii štítnej žľazy.
Vekom podmienené znaky prištítnych teliesok
Celková hmotnosť prištítnych teliesok u novorodenca kolíše medzi 6 a 9 mg. Počas prvého roka života sa ich celková hmotnosť zvýši 3-4-krát, do 5 rokov sa opäť zdvojnásobí a do 10 rokov sa strojnásobí. Po 20 rokoch celková hmotnosť štyroch prištítnych teliesok dosiahne 120-140 mg a zostáva konštantná až do staroby. Vo všetkých vekových kategóriách je hmotnosť prištítnych teliesok u žien o niečo väčšia ako u mužov.
Človek má zvyčajne dva páry prištítnych teliesok (horné a dolné), ktoré sa nachádzajú na zadnej strane štítnej žľazy, mimo jej puzdra, v blízkosti horného a dolného pólu. Počet a lokalizácia prištítnych teliesok sa však môže líšiť; niekedy sa nachádza až 12 prištítnych teliesok. Môžu sa nachádzať v tkanive štítnej žľazy a týmusu, v prednom a zadnom mediastine, v osrdcovníku, za pažerákom, v oblasti rozdvojenia krčnej tepny. Horné prištítne telieska majú tvar splošteného vajcovitého tvaru, dolné sú guľovité. Ich rozmery sú približne od 6x3 do 4x1,5 - 3 mm, celková hmotnosť je od 0,05 do 0,5 g, farba je červenkastá alebo žltkastohnedá. Krvné zásobenie prištítnych teliesok sa zabezpečuje hlavne vetvami dolnej štítnej tepny, venózny odtok prebieha cez žily štítnej žľazy, pažeráka a priedušnice. Prištítne telieska sú inervované sympatickými vláknami rekurentného a horného laryngeálneho nervu, parasympatickú inerváciu vykonávajú vagusové nervy. Prištítne telieska sú pokryté tenkou kapsulou spojivového tkaniva; septa, ktoré z nej vychádzajú, prenikajú do žliaz. Obsahujú krvné cievy a nervové vlákna. Parenchým prištítnych teliesok pozostáva z paratyrocytov alebo hlavných buniek, medzi ktorými sa podľa stupňa zafarbenia rozlišujú hormonálne aktívne svetlé alebo lesklé bunky, ako aj pokojové tmavé bunky. Hlavné bunky tvoria zhluky, šnúry a klastre a u starších ľudí folikuly s koloidom v dutine. U dospelých sa objavujú bunky, ktoré sa nachádzajú prevažne pozdĺž periférie prištítnych teliesok, zafarbené eozínom - eozinofilné alebo oxyfilné bunky, čo sú degenerujúce hlavné bunky. V prištítnych telieskach sa nachádzajú aj prechodné formy medzi hlavnými a oxyfilnými bunkami.
Prvé úspechy v objasňovaní otázok syntézy, dekódovania štruktúry a štúdia metabolizmu parathormónu sa dosiahli po roku 1972. Parathormón je jednoreťazcový polypeptid pozostávajúci z 84 aminokyselinových zvyškov, bez cysteínu, s molekulovou hmotnosťou približne 9500 daltonov, tvorený v prištítnych telieskach z bioprekurzora - proparathormónu (proPTH), ktorý má na NH2 konci ďalších 6 aminokyselín. ProPTH sa syntetizuje v hlavných bunkách prištítnych teliesok (v ich granulovanom endoplazmatickom retikule) a v procese proteolytického štiepenia v Golgiho aparáte sa premieňa na parathormón. Jeho biologická aktivita je výrazne nižšia ako aktivita PTH. Zdá sa, že proPTH v krvi zdravých ľudí chýba, ale v patologických stavoch (s adenómom prištítnych teliesok) sa môže vylučovať do krvi spolu s PTH. Nedávno bol objavený prekurzor proPTH, preproPTH, ktorý obsahuje ďalších 25 aminokyselinových zvyškov na NH2-konci. PreproPTH teda obsahuje 115 aminokyselinových zvyškov, proPTH 90 a PTH 84.
Štruktúra bovinného a bravčového parathormónu je teraz plne objasnená. Ľudský parathormón bol izolovaný z adenómov prištítnych teliesok, ale jeho štruktúra bola len čiastočne dešifrovaná. V štruktúre parathormónu existujú rozdiely, ale zvieracie a ľudské parathormóny vykazujú skríženú imunoreaktivitu. Polypeptid pozostávajúci z prvých 34 aminokyselinových zvyškov si prakticky zachováva biologickú aktivitu prirodzeného hormónu. To nám umožňuje predpokladať, že zostávajúcich takmer % molekuly na karboxylovom konci priamo nesúvisí s hlavnými účinkami parathormónu. Fragment 1-29 parathormónu tiež vykazuje určitú biologickú a imunologickú aktivitu. Biologicky neaktívny fragment 53-84 tiež vykazuje imunologický účinok, t. j. tieto vlastnosti parathormónu prejavujú aspoň 2 časti jeho molekuly.
Parathormón cirkulujúci v krvi je heterogénny a líši sa od pôvodného hormónu vylučovaného prištítnymi telieskami. V krvi sa rozlišujú najmenej tri rôzne typy parathormónu: intaktný parathormón s molekulovou hmotnosťou 9 500 daltonov; biologicky neaktívne látky z karboxylovej časti molekuly parathormónu s molekulovou hmotnosťou 7 000 – 7 500 daltonov; biologicky aktívne látky s molekulovou hmotnosťou približne 4 000 daltonov.
V venóznej krvi sa našli ešte menšie fragmenty, čo naznačuje, že sa tvorili na periférii. Hlavnými orgánmi, kde sa tvorili fragmenty parathormónu, boli pečeň a obličky. Fragmentácia parathormónu v týchto orgánoch bola zvýšená pri patológii pečene a chronickom zlyhaní obličiek (CRF). Za týchto podmienok zostávali fragmenty parathormónu v krvnom obehu výrazne dlhšie ako u zdravých jedincov. Pečeň absorbovala prevažne intaktný parathormón, ale neodstránila z krvi ani karboxy-terminálne, ani amino-terminálne fragmenty parathormónu. Obličky zohrávali vedúcu úlohu v metabolizme parathormónu. Predstavovali takmer 60 % metabolického klírensu karboxy-terminálneho imunoreaktívneho hormónu a 45 % amino-terminálneho fragmentu parathormónu. Hlavnou oblasťou metabolizmu aktívneho amino-terminálneho fragmentu parathormónu boli kosti.
Bola zistená pulzujúca sekrécia parathormónu, najintenzívnejšia v noci. Po 3-4 hodinách od začiatku nočného spánku je jeho obsah v krvi 2,5-3-krát vyšší ako priemerná denná hladina.
Hlavnou funkciou parathormónu je udržiavanie homeostázy vápnika. Zároveň je sérový vápnik (celkový a najmä ionizovaný) hlavným regulátorom sekrécie parathormónu (zníženie hladiny vápnika stimuluje sekréciu parathormónu, zatiaľ čo zvýšenie ju potláča), t. j. regulácia prebieha podľa princípu spätnej väzby. V podmienkach hypokalcémie sa zvyšuje premena proPTH na parathormón. Dôležitú úlohu pri uvoľňovaní parathormónu zohráva aj obsah horčíka v krvi (jeho zvýšená hladina stimuluje, zatiaľ čo znížená hladina potláča sekréciu parathormónu). Hlavnými cieľmi parathormónu sú obličky a kostry, ale je známy vplyv parathormónu na absorpciu vápnika v čreve, toleranciu sacharidov, hladiny lipidov v sére, jeho úloha pri vzniku impotencie, svrbenia kože atď.
Pre charakterizáciu účinku parathormónu na kosti je potrebné poskytnúť stručné informácie o štruktúre kostného tkaniva, vlastnostiach jeho fyziologickej resorpcie a prestavby.
Je známe, že prevažná časť vápnika v tele (až 99 %) je obsiahnutá v kostnom tkanive. Keďže sa v kostiach nachádza vo forme zlúčenín fosforu a vápnika, % celkového obsahu fosforu sa nachádza aj v kostiach. Ich tkanivo sa napriek svojej zdanlivej statickej povahe neustále remodeluje, aktívne vaskularizuje a má vysoké mechanické vlastnosti. Kosť je dynamickým „depom“ fosforu, horčíka a ďalších zlúčenín potrebných na udržanie homeostázy v metabolizme minerálov. Jej štruktúra zahŕňa husté minerálne zložky, ktoré úzko súvisia s organickou matricou, ktorá pozostáva z 90 – 95 % kolagénu, malého množstva mukopolysacharidov a nekolagénových proteínov. Minerálna časť kosti pozostáva z hydroxyapatitu – jeho empirický vzorec je Ca10 (PO4) 6 (OH) 2 – a amorfného fosforečnanu vápenatého.
Kosť je tvorená osteoblastmi pochádzajúcimi z nediferencovaných mezenchýmových buniek. Sú to mononukleárne bunky zapojené do syntézy zložiek organickej kostnej matrice. Sú umiestnené v monovrstve na povrchu kosti a sú v úzkom kontakte s osteoidom. Osteoblasty sú zodpovedné za ukladanie osteoidu a jeho následnú mineralizáciu. Produktom ich životne dôležitej činnosti je alkalická fosfatáza, ktorej obsah v krvi je nepriamym ukazovateľom ich aktivity. Obklopené mineralizovaným osteoidom sa niektoré osteoblasty menia na osteocyty - mononukleárne bunky, ktorých cytoplazma tvorí kanáliky spojené s kanálikmi susedných osteocytov. Nezúčastňujú sa na prestavbe kostí, ale sú zapojené do procesu perilakunárnej deštrukcie, ktorá je dôležitá pre rýchlu reguláciu hladiny vápnika v krvnom sére. Resorpciu kostí vykonávajú osteoklasty - obrovské polynukleárne bunky, ktoré zrejme vznikajú fúziou mononukleárnych makrofágov. Predpokladá sa tiež, že prekurzormi osteoklastov môžu byť hematopoetické kmeňové bunky kostnej drene. Sú pohyblivé, tvoria vrstvu v kontakte s kosťou, nachádzajú sa v oblastiach jej najväčšej resorpcie. V dôsledku uvoľňovania proteolytických enzýmov a kyslej fosfatázy osteoklasty spôsobujú degradáciu kolagénu, deštrukciu hydroxyapatitu a odstraňovanie minerálov z matrice. Novovytvorené slabo mineralizované kostné tkanivo (osteoid) je rezistentné voči osteoklastickej resorpcii. Funkcie osteoblastov a osteoklastov sú nezávislé, ale navzájom koordinované, čo vedie k normálnej prestavbe skeletu. Rast kostí do dĺžky závisí od endochondrálnej osifikácie, rast do šírky a hrúbky od periostálnej osifikácie. Klinické štúdie s 47 Ca ukázali, že až 18 % celkového obsahu vápnika v skelete sa obnovuje každý rok. Pri poškodení kostí (zlomeniny, infekčné procesy) sa zmenená kosť resorbuje a vzniká nová kosť.
Bunkové komplexy zapojené do lokálneho procesu resorpcie a tvorby kostí sa nazývajú základné viacbunkové remodelačné jednotky (BMU). Regulujú lokálnu koncentráciu vápnika, fosforu a ďalších iónov, syntézu organických zložiek kosti, najmä kolagénu, jej organizáciu a mineralizáciu.
Hlavným účinkom parathormónu v kostiach kostry je zvýšenie resorpcie, ktorá ovplyvňuje minerálne aj organické zložky kostnej štruktúry. Parathormón podporuje rast osteoklastov a ich aktivitu, čo je sprevádzané zvýšeným osteolytickým účinkom a zvýšením resorpcie kostí. V tomto prípade sa kryštály hydroxyapatitu rozpúšťajú za uvoľňovania vápnika a fosforu do krvi. Tento proces je hlavným mechanizmom zvyšovania hladiny vápnika v krvi. Pozostáva z troch zložiek: mobilizácia vápnika z perilakunárnej kosti (hlboké osteocyty); proliferácia osteoprogeneračných buniek do osteoklastov; udržiavanie konštantnej hladiny vápnika v krvi reguláciou jeho uvoľňovania z kosti (povrchové osteocyty).
Paratyreoidálny hormón teda spočiatku zvyšuje aktivitu osteocytov a osteoklastov, čím zvyšuje osteolýzu, čo spôsobuje zvýšenie hladiny vápnika v krvi a zvýšené vylučovanie vápnika a oxyprolínu močom. Toto je prvý, kvalitatívny, rýchly účinok paratyreoidálneho hormónu. Druhý účinok paratyreoidálneho hormónu na kosti je kvantitatívny. Je spojený so zvýšením zásoby osteoklastov. Pri aktívnej osteolýze dochádza k stimulácii zvýšenej proliferácie osteoblastov, aktivuje sa resorpcia aj tvorba kostí s prevahou resorpcie. Pri nadbytku paratyreoidálneho hormónu dochádza k negatívnej kostnej bilancii. To je sprevádzané nadmerným vylučovaním oxyprolínu - produktu degradácie kolagénu a sialových kyselín, ktoré sú súčasťou štruktúry mukopolysacharidov. Paratyreoidálny hormón aktivuje cyklický adenozínmonofosfát (cAMP). Zvýšené vylučovanie cAMP močom po podaní paratyreoidálneho hormónu môže slúžiť ako indikátor citlivosti tkaniva naň.
Najdôležitejším účinkom parathormónu na obličky je jeho schopnosť znižovať reabsorpciu fosforu, čím zvyšuje fosfatúriu. Mechanizmus redukcie v rôznych častiach nefrónu je odlišný: v proximálnej časti je tento účinok parathormónu spôsobený zvýšenou permeabilitou a prebieha za účasti cAMP, zatiaľ čo v distálnej časti nezávisí od cAMP. Fosfaturický účinok parathormónu sa mení s nedostatkom vitamínu D, metabolickou acidózou a zníženým obsahom fosforu. Parathormóny mierne zvyšujú celkovú tubulárnu reabsorpciu vápnika. Zároveň ju znižujú v proximálnych častiach a zvyšujú v distálnych častiach. Dominantný význam má parathormón - znižuje klírens vápnika. Parathormón znižuje tubulárnu reabsorpciu sodíka a jeho bikarbonátu, čo môže vysvetľovať rozvoj acidózy pri hyperparatyreoidizme. Zvyšuje tvorbu 1,25-dioxycholekalciferolu 1,25(OH2 ) D3 v obličkách - aktívnej formy vitamínu D3. Táto zlúčenina zvyšuje reabsorpciu vápnika v tenkom čreve stimuláciou aktivity špecifického proteínu viažuceho vápnik (CaBP) v jeho stene.
Normálna hladina parathormónu je v priemere 0,15 – 0,6 ng/ml. Líši sa v závislosti od veku a pohlavia. Priemerný obsah parathormónu v krvi ľudí vo veku 20 – 29 rokov je (0,245 ± 0,017) ng/ml, vo veku 80 – 89 rokov – (0,545 ± 0,048) ng/ml; hladina parathormónu u 70-ročných žien je (0,728 ± 0,051) ng/ml, u mužov rovnakého veku – (0,466 ± 0,40) ng/ml. Obsah parathormónu sa teda s vekom zvyšuje, ale vo väčšej miere u žien.
Na diferenciálnu diagnostiku hyperkalcémie by sa spravidla malo použiť niekoľko rôznych testov.
Predstavujeme klinickú a patogenetickú klasifikáciu, ktorú sme vyvinuli na základe klasifikácie O. V. Nikolaeva a V. N. Tarkaeva (1974).
Klinická a patogenetická klasifikácia ochorení spojených so zhoršenou sekréciou parathormónu a citlivosťou naň
Primárna hyperparatyreóza
- Patogenézou:
- hyperfunkčný(é) adenóm(y);
- hyperplázia OGD;
- hyperfunkčný karcinóm prištítnych teliesok;
- mnohopočetná endokrinná neoplázia typu I s hyperparatyreózou (Wermerov syndróm);
- mnohopočetná endokrinná neoplázia typu II s hyperparatyreózou (Sippleov syndróm).
- Podľa klinických znakov:
- forma kosti:
- osteoporotický,
- fibrocystická osteitída,
- „Pagetoid“;
- visceropatická forma:
- s prevládajúcim poškodením obličiek, gastrointestinálneho traktu, neuropsychiatrickej sféry;
- zmiešaná forma.
- forma kosti:
- Po prúde:
- pikantné;
- chronický.
Sekundárna hyperparatyreóza (sekundárna hyperfunkcia a hyperplázia prištítnych teliesok s predĺženou hypokalciémiou a hyperfosfatémiou)
- Patológia obličiek:
- chronické zlyhanie obličiek;
- tubulopatia (typ Albright-Fanconiho);
- renálna krivica.
- Črevná patológia:
- malabsorpčný syndróm.
- Patológia kostí:
- senilná osteomalácia;
- popôrodné;
- idiopatická;
- Pagetova choroba.
- Nedostatok vitamínu D:
- ochorenie obličiek;
- pečeň;
- dedičné nedostatky enzýmov.
- Zhubné ochorenia: myelóm.
Terciárny hyperparatyreoidizmus
- Autonómne fungujúci adenóm(y) prištítnych teliesok, vyvíjajúci sa na pozadí dlhotrvajúcej sekundárnej hyperparatyreózy.
Pseudohyperparatyreóza
- Produkcia parathormónu nádormi iného ako paratyreoidálneho pôvodu.
Hormonálne neaktívne cystické a nádorové útvary prištítnych teliesok
- Cysta.
- Hormonálne neaktívne nádory alebo karcinóm.
Hypoparatyreóza
- Vrodená nedostatočná vývojová schopnosť alebo absencia prištítnych teliesok.
- Idiopatický, autoimunitný pôvod.
- Pooperačné, vyvinuté v súvislosti s odstránením prištítnych teliesok.
- Pooperačné obdobie kvôli zhoršenému prekrveniu a inervácii.
- Radiačné poškodenie, exogénne a endogénne (externá rádioterapia, liečba ochorení štítnej žľazy rádioaktívnym jódom).
- Poškodenie prištítnych teliesok v dôsledku krvácania alebo infarktu.
- Infekčné lézie.
Pseudohypoparatyreóza
- Typ I - necitlivosť cieľových orgánov na parathormón, závislá od adenylátcyklázy;
- Typ II - necitlivosť cieľových orgánov na parathormón, nezávislá od adenylátcyklázy, pravdepodobne autoimunitného pôvodu.
Pseudopseudohypoparatyreóza
Prítomnosť somatických príznakov pseudohypoparatyreózy u zdravých príbuzných v rodinách pacientov s pseudohypoparatyreózou bez charakteristických biochemických porúch a bez tetánie.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]

