Prištítne telieska
Posledná kontrola: 23.04.2024

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
V roku 1879 švédsky vedec S. Sandstrom popísal prištítne gély u ľudí a dal im meno. Prištítne telieska sú životne dôležité orgány. Ich funkciou je produkcia a sekrécia paratyroidného hormónu (PTH) - jedného z hlavných regulátorov metabolizmu vápnika a fosforu.
Spárované hornej prištítnych teliesok (glandula paratyroidná superior) a dolná prištítne telieska (glandula paratyroidná nižšia) - je guľatý alebo vajcovitý teľa usporiadaná na zadnej ploche každej z lalokov štítnej žľazy, jeden nad železo, a druhý - spodné. Dĺžka každej žľazy je 4-8 mm, šírka - 3-4 mm, hrúbka 2-3 mm. Počet týchto žliaz nie je konštantný a môže sa pohybovať od 2 do 7 - 8, v priemere sú štyri. Celková hmotnosť žliaz je v priemere 1,18 g.
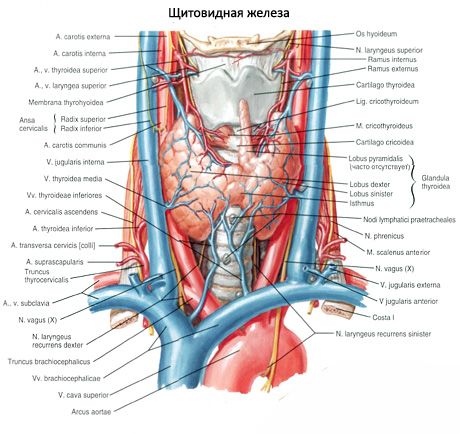
Prištítnej (prištítne) žľazy sa líšia od štítnej žľazy ľahším sfarbením (u detí sú svetlo ružové, u dospelých sú žltkasto hnedé). Často prištítne telieska sa nachádzajú v mieste penetrácie do štítnej žľazy nižších štítnej žľazy tepien alebo ich pobočiek. Z okolitých tkanív sú prištítne žľazy oddelené vlastnou vláknitou kapsulou, z ktorej vrstvy spojivového tkaniva opúšťajú žľazy. Posledné z nich obsahujú veľké množstvo krvných ciev a rozdeľujú prištítne telieska do skupín epiteliálnych buniek.
Parenchýmové žľazy tvoria hlavné a acidofilné paratyrocyty, ktoré tvoria vlákna a zhluky, obklopené tenkými zväzkami vlákien spojivového tkaniva. Oba typy buniek sa považujú za rozdielne štádiá vývoja paratyrocytov. Hlavné paratyrocyty majú polyhedrálny tvar, bazofilnú cytoplazmu s veľkým počtom ribozómov. Medzi týmito bunkami vylučujú tmavé (aktívne vylučujúce) a ľahké (menej aktívne). Acidofilné paratyrocyty sú veľké, s jasnými kontúrami, obsahujú veľa malých mitochondrií s časticami glykogénu.
Parathyroidný hormón paratyroidný hormón (paratyroidný hormón), proteínový hormón, sa podieľa na regulácii metabolizmu fosforu a vápnika. Paratyroidný hormón znižuje uvoľňovanie vápnika v moči, zvyšuje jeho absorpciu v čreve za prítomnosti vitamínu D. Antagonistom paratyroidného hormónu je tyrekalcitonín.
Embryogenéza prištítnych teliesok
Prištítne telieska sa vyvíjajú z epitelu spárovaných III a IV žiabrových vreciek. V siedmom týždni vývoja sa epiteliálne základy krviniek oddeľujú od stien žiabrových vreciek a v procese rastu sa miešajú v kaudálnom smere. V budúcnosti tvoria prírastkové prirodzené žľazy konštantnú polohu na zadných plochách pravého a ľavého laloku štítnej žľazy.
 [7], [8], [9], [10], [11], [12],
[7], [8], [9], [10], [11], [12],
Nádory a nervy prištítnych teliesok
Krvný prívod prištítnych teliesok sa uskutočňuje vetvami horných a dolných tyroidných artérií, ako aj v oblasti pažeráka a tracheálnej vetvy. Venózna krv prúdi pozdĺž žíl rovnakého mena. Inervácia prištítnych teliesok je podobná inervácii štítnej žľazy.
Vekové vlastnosti prištítnych teliesok
Celková hmotnosť prištítnych teliesok u novorodencov sa pohybuje od 6 do 9 mg. Počas prvého roka života sa ich celková hmotnosť zvyšuje o 3 až 4 krát, vo veku 5 rokov sa zdvojnásobuje a desať rokov trvá. Po 20 rokoch dosahuje celková hmotnosť štyroch prištítnych teliesok 120 až 140 mg a zostáva konštantná až do vysokého veku. Vo všetkých vekových kategóriách je hmotnosť prištítnych teliesok u žien o niečo väčšia ako u mužov.
Zvyčajne má človek dva páry prištítnych teliesok (horné a spodné) umiestnené na zadnom povrchu štítnej žľazy, mimo kapsuly, v blízkosti horných a dolných pólov. Avšak počet a umiestnenie prištítnych teliesok sa môže líšiť; niekedy až 12 prištítnych teliesok sa nachádza. Môžu byť umiestnené v tkanivách štítnej žľazy a týmusových žliaz, v prednom a zadnom mediastíne, v perikardu, za pažerákom, v karotidovej bifurkačnej oblasti. Horné prištítne telieska majú formu splošteného oválu, nižšie sú guľovité. Ich rozmery sú približne od 6x3 do 4x1,5 - 3 mm, celková hmotnosť od 0,05 do 0,5 g, farba je načervenalá alebo žltkasto sfarbená. Krvný obeh prištítnych teliesok sa uskutočňuje hlavne vetvami dolnej štítnej žľazy, venózny odtok sa prejavuje cez žily štítnej žľazy, pažeráka a priedušnice. Prištítne telieska sú sympatizujúce so sympatickými vláknami opakujúcich sa a horných laryngeálnych nervov, parasympatická inervácia sa vykonáva nervmi vagusov. Prištítne telieska sú pokryté tenkou spojivovou tkanivovou kapsulou; Rozdielne priečky prenikajú do žľazy. Obsahujú cievy a nervové vlákna. Parenchým prištítnych teliesok pozostáva z paratyreocytov alebo hlavných buniek, medzi ktorými stupeň rozlišovacej schopnosti rozlišuje hormonálne aktívne svetlo alebo lesklé, rovnako ako pokojné tmavé bunky. Hlavné bunky tvoria zhluky, pramene a zhluky a u starších ľudí a folikuly s koloidom v dutine. U dospelých sa bunky objavujú hlavne na okraji prištítnych teliesok zafarbených eozínom, eozinofilnými alebo oxyfilnými bunkami, ktoré sú degenerujúcimi hlavnými bunkami. V prištítnej žľaze sa medzi hlavnými a oxyfilnými bunkami nachádzajú prechodné formy.
Boli dosiahnuté prvé úspechy v objasňovaní syntézu otázky, dekódovanie konštrukcia, výmenu štúdie PTH po roku 1972 .. Parathormón - je jednoreťazcový polypeptid sa skladá z 84 aminokyselinových zvyškov, ktoré nemajú cysteínu s molekulovou hmotnosťou asi 9500 daltonov, je produkovaný v prištítnych teliesok z bioprekurzoru - proparatgormona (proPTG), ktoré majú 6 ďalšie aminokyseliny na NH 2 -kontse. ProPTG syntetizovaný v hlavných bunkách prištítnych teliesok (v ich granulované endoplasmatického retikula) a počas proteolytického štiepenia v Golgiho aparátu sa zmení na parathormónu. Jeho biologická aktivita je podstatne nižšia ako pri PTH. Zdá sa, že proPTG v krvi zdravých ľudí chýba, ale v patologických stavov (adenóm prištítnych teliesok), to môže byť vylučovaný do krvi spolu s PTH. V poslednej dobe bolo zistené, predchodca proPTG - preproPTG obsahujúce ďalšie zvyšky 25 aminokyselín na NH2-konci. Tak preproPTG obsahuje 115 aminokyselinových zvyškov proPTG - 90 a PTH - 84.
Teraz bola štruktúra hovädzieho a prasačího paratyroidného hormónu úplne zavedená. Paratyroidný hormón z adenómov prištítnych teliesok je izolovaný, ale jeho štruktúra je len čiastočne dešifrovaná. Existujú rozdiely v štruktúre paratyroidného hormónu, avšak paratormormóny zvierat a ľudí vykazujú krížovú reaktivitu. Polypeptid pozostávajúci z prvých 34 aminokyselinových zvyškov prakticky zachováva biologickú aktivitu prirodzeného hormónu. To nám umožňuje predpokladať, že zostávajúci takmer% molekuly na karboxylovom konci nie je priamo spojený s hlavnými účinkami paratyroidného hormónu. Určitá biologická a imunologická aktivita paratyroidného hormónu je tiež dokázaná jeho 1-29. Fragmentom. Imunologický účinok má aj biologicky inaktívny fragment 53-84, tj tieto vlastnosti paratormonónu vykazujú najmenej 2 časti svojej molekuly.
Cirkulácia v krvi parathyroidného hormónu je heterogénna, líši sa od natívneho hormónu vylučovaného prištítnymi žliazami. Existujú najmenej tri rôzne typy paratyroidného hormónu v krvi: intaktný paratyroidný hormón s molekulovou hmotnosťou 9500 daltonov; biologicky neaktívne látky z karboxylovej časti molekuly paratyroidného hormónu s molekulovou hmotnosťou 7000 až 7500 daltonov; biologicky aktívne látky s molekulovou hmotnosťou asi 4000 daltonov.
V žilovej krvi sa našli aj menšie fragmenty, čo naznačuje ich tvorbu na periférii. Hlavné orgány, v ktorých sa tvoria fragmenty paratyroidného hormónu, sú pečeň a obličky. Fragmentácia paratyroidného hormónu v týchto orgánoch sa zvyšuje s patológiou pečene a chronickým zlyhaním obličiek (CRF). Za týchto podmienok fragmenty paratyroidného hormónu pretrvávajú v krvi omnoho dlhšie ako u zdravých ľudí. Pečeň pohlcuje prevažne intaktný paratyroidný hormón, ale neodoberá z krvi buď karboxylové terminálne alebo aminokoncéme fragmenty paratyroidného hormónu. Vedúcu úlohu v metabolizme paratyroidného hormónu hrajú obličky. Predstavujú takmer 60% metabolického klírensu karboxylového terminálneho imunoreaktívneho hormónu a 45% aminoterminálneho fragmentu paratyroidného hormónu. Hlavnou oblasťou metabolizmu aktívneho aminoterminálneho fragmentu paratyroidného hormónu sú kosti.
Bola zistená pulzná sekrécia paratyroidného hormónu, najintenzívnejšia v noci. Po 3-4 hodinách od začiatku nočného spánku je jeho obsah v krvi 2,5 až 3-krát vyšší ako priemerná denná hladina.
Hlavnou funkciou paratyroidného hormónu je udržanie homeostázy vápnika. Avšak, sérové kalcium (celkové a ionizovanej zvlášť) je hlavným regulátorom sekrécie parathormónu (zníženie vápnika stimuluje sekréciu paratyroidná hormón, zvyšuje - potláča), teda regulácia sa vykonáva na princípe spätnej väzby ... V hypokalciémii sa zvýši konverzia proPTG na paratyroidný hormón. Uvoľňovanie parathormónu hrá dôležitú úlohu v obsahu v krvi horčíka (zvýšené hladiny stimuluje a nízku - potláča sekréciu parathormónu). Hlavné ciele sú parathormónu obličky a kosti kostry, ale vieme, že účinok parathormónu na absorpciu vápnika v čreve, tolerancia na sacharidy, lipidy v krvnom sére, jeho úlohu vo vývoji impotencia, svrbenie a tak ďalej. D.
Na charakterizovanie účinku paratyroidného hormónu na kosť je potrebné poskytnúť stručné informácie o štruktúre kostného tkaniva, o zvláštnostiach jeho fyziologickej resorpcie a remodelácii.
Je známe, že väčšina vápnika prítomného v tele (až do 99%) je obsiahnutá v kostnom tkanive. Keďže je v kosti vo forme zlúčenín fosforu a vápnika,% celkového obsahu fosforu sa nachádza aj v kostiach. Ich tkanivo, napriek zdanlivej statike, sa neustále remodeluje, aktívne vaskularizuje a má vysoké mechanické vlastnosti. Kosť je dynamický "depot" fosforu, horčíka a ďalších zlúčenín potrebných na udržanie homeostázy v minerálnom metabolizme. Jeho štruktúra obsahuje husté minerálne zložky, ktoré sú v úzkom spojení s organickou matricou, ktorá pozostáva z 90-95% kolagénu, malých množstiev mukopolysacharidov a ne-kolagénových proteínov. Minerálna časť kosti pozostáva z hydroxyapatitu - jeho empirického vzorca je Ca10 (PO4) 6 (OH) 2 - a amorfný fosforečnan vápenatý.
Kosť je tvorená osteoblastmi pochádzajúcimi z nediferencovaných mezenchymálnych buniek. Jedná sa o mononukleárne bunky zapojené do syntézy zložiek organickej matrice kosti. Sú umiestnené v monovrstve na povrchu kostí a sú v tesnom kontakte s osteoidom. Osteoblasty sú zodpovedné za depozíciu osteoidu a jeho následnú mineralizáciu. Výrobkom ich života je alkalická fosfatáza, ktorej obsah v krvi je nepriamym ukazovateľom ich aktivity. Obklopené mineralizovaným osteidom sa niektoré osteoblasty menia na osteocyty - mononukleárne bunky, ktorých cytoplazma tvorí tubuly spojené s tubulmi susedných osteocytov. Nepodieľajú sa na prestavbe kostí, ale podieľajú sa na procese perilakunálnej deštrukcie, ktorá je dôležitá pre rýchlu reguláciu hladín vápnika v sére. Kostná resorpcia sa uskutočňuje prostredníctvom osteoklastov - obrovských polynukleárnych buniek, ktoré sú zrejme tvorené fúziou mononukleárnych makrofágov. Predpokladá sa tiež, že prekurzormi osteoklastov môžu byť hematopoetické kmeňové bunky kostnej drene. Sú pohyblivé, tvoria vrstvu v kontakte s kosťou a nachádzajú sa v oblastiach s najväčšou resorpciou. Vzhľadom na izoláciu proteolytických enzýmov a kyslej fosfatázy spôsobujú osteoklasty degradáciu kolagénu, deštrukciu hydroxyapatitu a elimináciu minerálov z matrice. Novo vytvorené mierne mineralizované kostné tkanivo (osteoid) je odolné voči resorpcii osteoklastov. Funkcie osteoblastov a osteoklastov sú nezávislé, ale navzájom konzistentné, čo vedie k normálnej remodelácii kostry. Rast kosti v dĺžke závisí od enchondrálnej osifikácie, rastu šírky a hrúbky jej - od osídlenia v periostile. Klinické štúdie s 47 Ca ukázali, že každý rok sa aktualizuje až 18% celkového obsahu vápnika v kostre. Ak sú kosti poškodené (zlomeniny, infekčné procesy), resekovaná kosť sa resorbuje a vzniká nová kosť.
Komplexy buniek, ktoré sa podieľajú na lokálnom procese resorpcie kostí a tvorbe kostí, sa nazývajú základné viacbunkové jednotky remodelingu (BMI - Basic multicellular unit). Regulujú lokálnu koncentráciu vápnika, fosforu a iných iónov, syntézu organických zložiek kosti, najmä kolagénu, jeho organizáciu a mineralizáciu.
Hlavným účinkom paratyroidného hormónu v kostiach kostry je zintenzívnenie procesov resorpcie, ktoré ovplyvňujú ako minerálne, tak organické zložky kostnej štruktúry. Paratyroidný hormón podporuje rast osteoklastov a ich aktivitu, čo je spojené so zvýšeným osteolytickým účinkom a zvýšením resorpcie kostí. Tým sa rozpúšťajú kryštály hydroxyapatitu s uvoľnením vápnika a fosforu do krvi. Tento proces je hlavným mechanizmom zvýšenia hladiny vápnika v krvi. Skladá sa z troch zložiek: mobilizácia vápnika z perilakunárnej kosti (hlboké osteocyty); proliferácia osteo-progenitorových buniek v osteoklastoch; udržiavanie konštantnej hladiny vápnika v krvi reguláciou jeho uvoľňovania z kostí (povrchové osteocyty).
Takto paratyroidný hormón spočiatku zvyšuje aktivitu osteocytov a osteoklastov, posilňuje osteolýzu, spôsobuje zvýšenie hladiny vápnika v krvi a zvyšuje vylučovanie močom a hydroxyprolínom. Toto je prvý, kvalitatívny, rýchly účinok paratyroidného hormónu. Druhý účinok pôsobenia parathormónu na kosť je kvantitatívny. Je spojená s nárastom objemu osteoklastov. Pri aktívnej osteolýze existuje podnet na zvýšenú reprodukciu osteoblastov a aktivuje sa resorpcia a tvorba kostí s prevahou resorpcie. Pri nadbytku paratyroidného hormónu dochádza k negatívnej kostnej bilancii. To je sprevádzané nadmerným uvoľňovaním hydroxyprolínu, produktu degradácie kolagénu a kyseliny sialovej, ktoré sú súčasťou štruktúry mukopolysacharidov. Paratyroidný hormón aktivuje cyklický adenozínmonofosfát (cAMP). Zvýšená exkrécia cAMP v moči po podaní parathormónu môže slúžiť ako indikátor citlivosti na tkanivo.
Najdôležitejším účinkom paratyroidného hormónu na obličky je jeho schopnosť znižovať reabsorpciu fosforu a zvyšovať fosfatúru. Mechanizmus zníženia v rôznych častiach nefrónu sa líšia: v proximálnej časti tohto efektu je v dôsledku zvýšenia priepustnosti parathormónu a dochádza s účasťou cAMP v distálnej - je nezávislá na cAMP. Fosfatárny účinok paratyroidného hormónu sa mení s nedostatkom vitamínu D, metabolickou acidózou a znížením obsahu fosforu. Paratyroidné hormóny mierne zvyšujú celkovú tubulárnu reabsorpciu vápnika. Súčasne ju znižuje v proximálnej a zvyšuje ju v distálnych častiach. Ten má dominantnú úlohu - paratyroidný hormón znižuje klírens vápnika. Paratyroidný hormón znižuje tubulárnu reabsorpciu sodíka a jeho bikarbonátu, čo vysvetľuje vznik acidózy pri hyperparatyroidizme. To zvyšuje tvorbu obličiek dioksiholekaltsiferola 1,25-1,25 (OH 2 ) D 3 - aktívna forma vitamínu D 3. Táto zlúčenina zvyšuje reabsorpciu vápnika v tenkom čreve stimuláciou aktivity špecifického proteínu vázajúceho vápnik (Ca-väzbový proteín, CaBP) v jeho stene.
Normálna hladina paratyroidného hormónu je v priemere 0,15-0,6 ng / ml. Rôzne závisí od veku a pohlavia. Priemerný obsah paratyroidného hormónu v krvi ľudí vo veku 20-29 rokov (0,245 ± 0,017) ng / ml, 80-89 rokov - (0,545 ± 0,048) ng / ml; hladina paratyroidného hormónu u 70-ročných žien (0,728 ± 0,051) ng / ml u mužov rovnakého veku - (0,466 ± 0,40) ng / ml. Preto sa obsah paratyroidného hormónu zvyšuje s vekom, ale viac u žien.
Pre diferenciálnu diagnostiku hyperkalcémie sa spravidla používa niekoľko rôznych testov.
Prezentujeme klinicko-patogenetickú klasifikáciu, ktorú sme vyvinuli na základe klasifikácie OV Nikolaev a VN Tarkaeva (1974).
Klinicko-patogénna klasifikácia ochorení spojených so zhoršenou sekréciou paratyroidného hormónu a jeho citlivosťou
Primárna hyperparatyreóza
- Patogenéziou:
- hyperfunkčný adenóm (adenómy);
- gipsy OGZHZH;
- hyperfunkčný karcinóm prištítnych teliesok;
- viacnásobná endokrinná neoplázia typu I s hyperparatyroidizmom (Vermeerov syndróm);
- viacnásobná endokrinná neoplázia typu II s hyperparatyroidizmom (Sippleov syndróm).
- Klinickými znakmi:
- kostná forma:
- osteoporotic,
- fibro-cystická osteitída,
- "Pagetoid";
- visceropatická forma:
- s primárnou léziou obličiek, gastrointestinálnym traktom, neuropsychickou sférou;
- zmiešaná forma.
- kostná forma:
- Zostupný prúd:
- akútne;
- chronické.
Hyperparatyroidizmus sekundárny (sekundárna hyperfunkcia a hyperplázia prištítnych teliesok s predĺženou hypokalciémiou a hyperfosfatémiou)
- Patológia obličiek:
- chronické zlyhanie obličiek;
- tubulopatia (ako je Albright-Fanconi);
- obličkové rachity.
- Črevná patológia:
- syndróm zhoršenej intestinálnej absorpcie.
- Kostná patológia:
- osteomalacia senil;
- šestonedelí;
- idiopaticheskaya;
- Pagetova choroba.
- Nedostatok vitamínu D:
- ochorenie obličiek;
- pečene;
- dedičné enzýmopatie.
- Malígne ochorenia: myelóm.
hyperparatyreóza terciárne
- Autonómne fungujúci adenóm (adenóm) prištítnych teliesok, vyvíjajúci sa na pozadí dlhodobého sekundárneho hyperparatyroidizmu.
Psevdogiperparatireoz
- Produkcia paratyroidného hormónu nádormi neparatiroidného pôvodu.
Hormonálne neaktívne cystické a nádorové formácie prištítnych teliesok
- Cysta.
- Hormonálne neaktívne nádory alebo karcinóm.
Gipoparatireoz
- Vrodená maldevelopment alebo absencia prištítnych teliesok.
- Idiopatická, autoimunitná genéza.
- Pooperačné, vyvinuté v súvislosti s odstránením prištítnych teliesok.
- Po operácii v dôsledku zhoršeného zásobovania krvou a inervácie.
- Zranenia spôsobené žiarením, exogénne a endogénne (diaľková rádioterapia, liečba štítnej žľazy rádioaktívnym jódom).
- Poškodenie príštitných žliaz s krvácaním, infarktom.
- Infekčné poškodenie.
Pseudohypoparathyreosis
- I typu - necitlivosť cieľových orgánov na paratyroidný hormón, v závislosti od adenylátcyklázy;
- Typ II je necitlivosť cieľových orgánov na paratyroidný hormón, nezávisle od adenylátcyklázy, prípadne autoimunitnej generácie.
Pseudo-pseudohypyparatyreóza
Prítomnosť somatických znakov pseudohypoparatyroidizmu u zdravých príbuzných v rodinách pacientov s pseudohypoparatyroidizmom bez charakteristických biochemických porúch a bez tetany.

