Lekársky expert článku
Nové publikácie
Lieky
Neuroleptiká alebo antipsychotiká
Posledná kontrola: 04.07.2025

Všetok obsah iLive je lekársky kontrolovaný alebo kontrolovaný, aby sa zabezpečila čo najväčšia presnosť faktov.
Máme prísne smernice týkajúce sa získavania zdrojov a len odkaz na seriózne mediálne stránky, akademické výskumné inštitúcie a vždy, keď je to možné, na lekársky partnerské štúdie. Všimnite si, že čísla v zátvorkách ([1], [2] atď.) Sú odkazmi na kliknutia na tieto štúdie.
Ak máte pocit, že niektorý z našich obsahov je nepresný, neaktuálny alebo inak sporný, vyberte ho a stlačte kláves Ctrl + Enter.
Antipsychotiká (neuroleptiká) sú triedou psychotropných liekov používaných predovšetkým na liečbu schizofrénie. V súčasnosti sa bežne rozlišujú dve skupiny (alebo kategórie) liekov: typické a atypické antipsychotiká. Nižšie sú uvedené informácie o farmakologických vlastnostiach, indikáciách na použitie a vedľajších účinkoch liečby pre každú z týchto skupín liekov.
Indikácie pre použitie typických antipsychotík
V súčasnosti medzi hlavné indikácie pre predpisovanie tradičných neuroleptík podľa odporúčaní autoritatívnych výskumníkov v oblasti psychofarmakoterapie patria nasledujúce.
- Zmiernenie psychomotorickej agitácie a porúch správania spôsobených závažnými psychotickými príznakmi. V týchto prípadoch je indikované použitie perorálnych alebo parenterálnych foriem liekov s antipsychotickým účinkom, a to ako globálnych (klopromazín, levomepromazín, tioproperazín, zuklopentixol), tak aj selektívnych - vo forme účinku na halucinogénne-paranoidné poruchy (haloperidol, trifluoperazín).
- Antirelapsová (preventívna) terapia. Na tento účel sa predpisujú depotné formy liekov, najmä u pacientov so slabou liečbou liekmi (haloperidol dekanoát, predĺžená forma flupentixolu), alebo malé alebo stredné dávky liekov na dosiahnutie disinhibičného (antinegatívneho) účinku, z tých liekov, ktorých vysoké dávky sa používajú na zmiernenie akútnych psychotických porúch (flupentixol, zuklopentixol). Pri tomto type terapie sa odporúča aj predpisovanie tzv. malých neuroleptík (tioridazín, chlórprotixén, sulpirid), ktorých psychotropná aktivita spočíva v účinku na prejavy depresívneho pólu a nespavosti.
- Prekonanie terapeutickej rezistencie na atypické antipsychotiká pri liečbe akútnych psychotických stavov. Na tento účel sa zvyčajne používajú parenterálne formy tradičných antipsychotík s globálnym (chlórpromazín, levomepromazín atď.) a selektívnym (haloperidol) antipsychotickým účinkom.
Tieto lieky spôsobujú rôzne vedľajšie účinky, ktorých povaha závisí od charakteristík farmakologického profilu každého lieku. Antipsychotiká s výraznejším cholinolytickým účinkom častejšie spôsobujú poruchy akomodácie, zápchu, sucho v ústach a retenciu moču. Sedatívny účinok je typickejší pre antipsychotiká s výrazným antihistaminovým účinkom a ortostatická hypotenzia je typickejšia pre lieky, ktoré blokujú a1-adrenergné receptory. Blokáda cholinergného, nordrenergného a dopaminergného prenosu typickými neuroleptikami môže viesť k množstvu porúch v sexuálnej sfére, ako je amenorea alebo dysmenorea, anorgazmia, galaktorea, opuch a bolestivosť mliečnych žliaz a znížená potencia. Vedľajšie účinky v sexuálnej sfére sú spojené najmä s cholinolytickými a adrenoblokujúcimi vlastnosťami týchto liekov a tiež so zvýšením sekrécie prolaktínu v dôsledku blokády metabolizmu dopamínu. Najzávažnejšími vedľajšími účinkami typických neuroleptík sú motorické dysfunkcie. Sú najčastejším dôvodom, prečo pacienti prestávajú užívať lieky. Tri hlavné vedľajšie účinky terapie spojené s vplyvom na motorickú sféru zahŕňajú skoré extrapyramídové syndrómy, tardívnu dyskinézu a NMS.
Predpokladá sa, že extrapyramídové syndrómy sú spojené s blokádou D2 receptorov v bazálnych gangliách. Patria medzi ne dystónia, neuroleptický parkinsonizmus a akatízia. Medzi prejavy akútnej dystonickej reakcie (skorá dyskinéza) patrí náhle sa rozvíjajúca hyperkinéza, okulogyrické krízy, kontrakcie svalov tváre a trupu, opistotonus. Tieto poruchy sú závislé od dávky a často sa vyskytujú po 2 – 5 dňoch liečby vysoko účinnými neuroleptikami, ako sú haloperidol a flufenazín. Na zmiernenie skorej dyskinézy sa dávka neuroleptika znižuje a predpisujú sa anticholinergiká (biperiden, trihexyfenidyl). Tardívna dyskinéza zvyčajne postihuje svaly krku a na rozdiel od akútnej dystonickej reakcie menej reaguje na liečbu anticholinergikami. Neuroleptický parkinsonizmus sa vyznačuje zníženou spontánnou motorikou, hypo- a amimiou, pokojovým tremorom a rigiditou. Je dôležité odlíšiť tieto príznaky od navonok podobných negatívnych porúch pri schizofrénii, ktoré sa prejavujú emocionálnym odcudzením, otupením afektu a anergiou. Na nápravu týchto vedľajších účinkov je indikované použitie anticholinergík, zníženie dávky neuroleptika alebo jeho nahradenie atypickým antipsychotikom. Akatízia sa prejavuje vnútornou úzkosťou, neschopnosťou dlhodobo zotrvať na jednom mieste a potrebou neustáleho pohybu rúk alebo nôh. Na jej zmiernenie sa používajú anticholinergiká a centrálne betablokátory (propranolol).
Neskorá dyskinéza sa prejavuje mimovoľnými pohybmi akejkoľvek svalovej skupiny, najčastejšie svalov jazyka a úst. Klinicky sa rozlišuje niekoľko jej foriem: dyskinéza svalov líc, jazyka, úst (periodické kontrakcie žuvacích svalov, vytvárajúce dojem grimasy, jazyk môže mimovoľne vyčnievať z úst pacienta); tardívna dystónia a tardívna akatízia; (pacient robí choreoatetoidné pohyby hlavy, trupu, horných a dolných končatín). Táto forma poruchy sa zaznamenáva najmä počas dlhodobej liečby tradičnými neuroleptikami a zisťuje sa u približne 15 – 20 % pacientov, ktorí ich užívajú ako udržiavaciu liečbu. Pravdepodobne je u niektorých pacientov zvýšené riziko vzniku príznakov dyskinézy, pretože niektoré z nich boli pozorované v klinike schizofrénie ešte pred „neuroleptickou érou“. Okrem toho bola tardívna dyskinéza opísaná u starších žien a pacientov s afektívnymi poruchami. Predpokladá sa, že tardívna dyskinéza je spojená so zvýšením počtu dopamínových receptorov v striate, hoci na jej patogenéze sa pravdepodobne podieľajú aj GABAergné a iné neurotransmiterové systémy. Neexistuje účinná univerzálna liečba takýchto vedľajších účinkov. Predpokladá sa, že nízke dávky vysoko účinných neuroleptík s blokujúcim účinkom dopamínu alebo vitamínu E môžu mať pri týchto poruchách mierny priaznivý účinok. Najúčinnejším opatrením pri tardívnej dyskinéze je zníženie dávky typického neuroleptika alebo jeho nahradenie atypickým antipsychotikom.
Podľa súčasných údajov sa neuroleptický malígny syndróm vyskytuje približne v 0,5 % prípadov psychofarmakoterapie. Zriedkavý výskyt takejto život ohrozujúcej komplikácie možno v súčasnosti vysvetliť rozsiahlym zavedením atypických antipsychotík do praxe, pretože riziko vzniku NMS počas liečby týmito liekmi je nevýznamné. Všeobecne sa uznáva, že hlavnou príčinou vzniku NMS je nadmerná blokáda dopaminergného systému počas liečby neuroleptikami, najmä po zvýšení dávky vysoko účinného antipsychotika. Hlavnými príznakmi NMS sú hypertermia, zvýšený tonus kostrových svalov a šľachových reflexov, zhoršené vedomie s prechodom do kómy. Krvné testy odhaľujú leukocytózu, zvýšenú sedimentáciu erytrocytov, aktivitu pečeňových transamináz; testy moču odhaľujú prítomnosť albuminúrie. Poruchy rovnováhy vody a elektrolytov sa vyskytujú rýchlo, čo vytvára predpoklady pre vznik mozgového edému. NMS je akútny stav vyžadujúci urgentnú hospitalizáciu pacienta na intenzívnu infúznu liečbu. Pri liečbe NMS je najdôležitejšia hydratácia a symptomatická liečba. V tejto situácii je potrebné okamžite vysadiť akékoľvek predpísané neuroleptiká. V niektorých prípadoch majú agonisty dopamínových receptorov (napríklad bromokriptín) alebo svalové relaxanciá pozitívny účinok, hoci ich účinnosť nebola skúmaná. Po odstránení NMS by sa neuroleptikum nemalo obnoviť aspoň dva týždne. Následne sa môže predpísať antipsychotikum s nízkou účinnosťou, najlepšie liek novej generácie. Dávku novo predpísaného lieku treba zvyšovať mimoriadne opatrne, pričom sa má sledovať stav vitálnych funkcií a laboratórne údaje (krvné a močové testy).
Typické neuroleptiká zriedkavo spôsobujú nebezpečné smrteľné komplikácie. Prejavy predávkovania súvisia najmä s individuálnym profilom antiadrenergného a anticholinergného účinku lieku. Keďže tieto lieky majú silný antiemetický účinok, na ich vylúčenie z tela je indikovaný výplach žalúdka, a nie podanie emetík. Arteriálna hypotenzia je spravidla dôsledkom blokády adrenergných receptorov a mala by sa korigovať podaním dopamínu a norepinefrínu. V prípade srdcovej arytmie je indikované použitie lidokaínu.
Mechanizmus účinku a farmakologické účinky typických antipsychotík
S rozvojom psychofarmakológie boli navrhnuté rôzne možnosti účinku antipsychotík na neuroreceptory. Hlavnou hypotézou zostáva, že ovplyvňujú dopamínové neurostruktúry (predovšetkým D2 receptory), a to na základe údajov o narušení normálneho metabolizmu dopamínu v mozgových štruktúrach pri psychózach. Dopamínové D2 receptory sa nachádzajú v bazálnych gangliách, nucleus accumbens a frontálnom kortexe; zohrávajú vedúcu úlohu v regulácii toku informácií medzi mozgovou kôrou a talamom.
Obrázok demonštruje podrobnejšie pochopenie porúch prenosu dopamínu v kortikálnych a subkortikálnych oblastiach mozgu a úlohy týchto porúch pri rozvoji symptómov schizofrénie (adaptované z monografie Jones RB, Buckley PF, 2006).
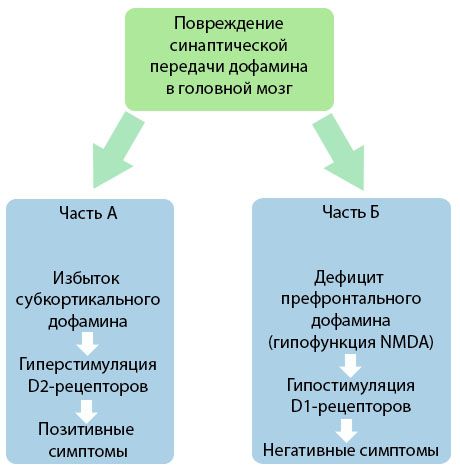
Časť A odráža klasickú, ranú dopamínovú teóriu, ktorá postuluje nadbytok dopamínu v subkortikálnych oblastiach a hyperstimuláciu D2 receptorov, čo vedie k vzniku produktívnych symptómov. Časť B demonštruje následnú modernizáciu teórie začiatkom 90. rokov 20. storočia. Údaje získané v tomto čase odhalili, že nedostatok dopamínu v D receptoroch spolu s nedostatočnou stimuláciou týchto receptorov v prefrontálnom kortexe vedie k vzniku negatívnych symptómov a kognitívnych deficitov. Preto sú podľa moderného chápania oba typy porúch dopamínergného prenosu - nadbytok subkortikálneho dopamínu a jeho nedostatok v prefrontálnom kortexe - kombinovaným výsledkom narušenia synaptického prenosu v prefrontálnej oblasti a sú spojené s hypofunkciou N-metyl-N-aspartátu. Okrem pôvodne izolovaného dopamínu boli neskôr identifikované aj ďalšie neurotransmitery zapojené do patogenézy schizofrénie, ako je serotonín, kyselina gama-aminomaslová, glutamát, norepinefrín, acetylcholín a rôzne neuropeptidy. Hoci úloha týchto mediátorov nebola úplne preskúmaná, s rozvojom poznatkov sa ukazuje, že prejavom mnohých neurochemických posunov v tele je. Klinický účinok antipsychotického lieku je preto súhrnom účinkov na rôzne receptorové formácie a vedie k eliminácii porúch homeostázy.
V posledných rokoch sa vďaka vzniku nových výskumných metód, ako je väzba rádioizotopových ligandov a PET skenovanie, dosiahol významný pokrok v objasňovaní jemného biochemického mechanizmu účinku neuroleptík. Najmä bola stanovená porovnávacia sila a tropizmus liekov viazať sa na jednotlivé neuroreceptory v rôznych oblastiach a štruktúrach mozgu. Bola preukázaná priama závislosť závažnosti antipsychotického účinku lieku od sily jeho blokujúceho účinku na rôzne dopaminergné receptory. Nedávno boli identifikované štyri typy takýchto receptorov:
- D1 sa nachádzajú prevažne v oblasti substantia nigra a striata (tzv. nigrostriatálna oblasť), ako aj v prefrontálnej oblasti;
- D2 - v nigrostriatálnych, mezolimbických oblastiach a prednej hypofýze (sekrécia prolaktínu);
- D3 (presynaptický) - v rôznych mozgových štruktúrach riadi dopaminergnú aktivitu podľa zákona negatívnej spätnej väzby;
- D4 (presynaptický) - prevažne v nigrostriatálnej a mezolimbickej oblasti.
Zároveň možno teraz považovať za dokázané, že práve blokáda D2 receptorov spôsobuje rozvoj antipsychotík, sekundárnych sedatívnych účinkov, ako aj extrapyramídových vedľajších účinkov. Ďalšími klinickými prejavmi blokády tohto typu receptorov sú analgetický a antiemetický účinok neuroleptík (zníženie nevoľnosti, vracania v dôsledku potlačenia centra vracania), ako aj zníženie obsahu rastového hormónu a zvýšenie produkcie prolaktínu (neuroendokrinné vedľajšie účinky vrátane galaktorey a menštruačných nepravidelností). Dlhodobá blokáda nigrostriatálnych D2 receptorov vedie k vzniku ich precitlivenosti, ktorá je zodpovedná za rozvoj tardívnych dyskinéz a „hypersenzitívnych psychóz“. Pravdepodobné klinické prejavy blokády presynaptických D3 a D4 receptorov sú spojené najmä so stimulačným účinkom neuroleptík. Vďaka čiastočnej blokáde týchto receptorov v nigrostriatálnej a mezolimbokortikálnej oblasti môžu aktivačné a incizívne (silné, vysoko aktívne) neuroleptiká v malých dávkach stimulovať a vo vysokých dávkach potláčať dopaminergný prenos.
V posledných rokoch prudko vzrástol záujem o funkciu serotonergných systémov mozgu vrátane serotonínových receptorov. Faktom je, že v rôznych častiach mozgu má serotonergný systém modulačný účinok na dopaminergné štruktúry. Najmä v mezokortikálnej oblasti serotonín inhibuje uvoľňovanie dopamínu, a preto blokáda postsynaptických 5-HT receptorov vedie k zvýšeniu obsahu dopamínu. Ako je známe, rozvoj negatívnych symptómov pri schizofrénii je spojený s hypofunkciou dopamínových neurónov v prefrontálnych štruktúrach mozgovej kôry. V súčasnosti je známych približne 15 typov centrálnych 5-HT receptorov. Experimentálne sa zistilo, že neuroleptiká sa viažu hlavne na 5-HT receptory prvých troch typov.
Tieto lieky majú prevažne stimulačný (agonistický) účinok na 5-HT1a receptory. Pravdepodobné klinické dôsledky: zvýšená antipsychotická aktivita, zníženie závažnosti kognitívnych porúch, korekcia negatívnych symptómov, antidepresívny účinok a zníženie výskytu extrapyramídových vedľajších účinkov.
Účinok neuroleptík na 5-HT2 receptory, najmä na podtypy 5-HT2a, má značný význam. Nachádzajú sa prevažne v mozgovej kôre a ich citlivosť je u pacientov so schizofréniou zvýšená. Schopnosť neuroleptík novej generácie znižovať závažnosť negatívnych symptómov, zlepšovať kognitívne funkcie, regulovať spánok zvýšením celkovej dĺžky pomalovlnných (D-vlnných) fáz spánku, znižovať agresivitu a zmierňovať depresívne symptómy a migrénovité (vznikajúce z cerebrovaskulárnych porúch) bolesti hlavy sa spája s blokádou 5-HT2a receptorov. Na druhej strane, pri blokáde 5-HT2a receptorov sú možné hypotenzívne účinky a poruchy ejakulácie u mužov.
Predpokladá sa, že účinok neuroleptík na 5-HT2c receptory spôsobuje sedatívny (anxiolytický) účinok, zvýšenú chuť do jedla (sprevádzanú zvýšením telesnej hmotnosti) a zníženie produkcie prolaktínu.
Receptory 5-HT3 sa nachádzajú prevažne v limbickej oblasti a keď sú blokované, najprv sa rozvinie antiemetický účinok a zosilnia sa aj antipsychotické a anxiolytické účinky.
Výskyt symptómov podobných Parkinsonovej chorobe závisí aj od blokovacej sily lieku na muskarínové cholinergné receptory. Cholinolytické a dopamínblokujúce účinky sú do istej miery v recipročných vzťahoch. Je napríklad známe, že v nigrostriatálnej oblasti D2 receptory inhibujú uvoľňovanie acetylcholínu. Keď je blokovaných viac ako 75 % D2 receptorov v nigrostriatálnej oblasti, rovnováha je narušená v prospech cholinergného systému. To je dôvod korektívneho účinku anticholinergných liekov (korektorov) na neuroleptické extrapyramídové vedľajšie účinky. Chlórprotixén, klozapín a olanzapín majú vysokú afinitu k muskarínovým receptorom a prakticky nespôsobujú extrapyramídové vedľajšie účinky, pretože blokujú cholinergné aj dopaminergné receptory súčasne. Deriváty haloperidolu a piperazínu fenotiazínu majú výrazný účinok na dopamínové receptory, ale veľmi slabý účinok na cholínové receptory. Je to spôsobené ich schopnosťou spôsobovať výrazné extrapyramídové vedľajšie účinky, ktoré sa znižujú pri použití veľmi vysokých dávok, keď sa prejaví cholinolytický účinok. Okrem zníženia blokujúceho účinku dopamínu na D2 receptory nigrostriatálnej oblasti a vyrovnania extrapyramídových vedľajších účinkov môže silný cholinergný účinok spôsobiť zhoršenie kognitívnych funkcií vrátane porúch pamäti, ako aj periférne vedľajšie účinky (suché sliznice, zhoršená zraková akomodácia, zápcha, retencia moču, zmätenosť atď.). Neuroleptiká majú pomerne silný blokujúci účinok na histamínové receptory typu I, čo je spojené predovšetkým so závažnosťou sedatívneho účinku, ako aj so zvýšením telesnej hmotnosti v dôsledku zvýšenej chuti do jedla. Antialergické a antipruritické účinky neuroleptík sú tiež spojené s ich antihistaminikovými vlastnosťami.
Okrem blokovania dopamínu má väčšina neuroleptík antiserotonergné, cholinolytické a antihistaminické účinky adrenolytické vlastnosti, t. j. blokujú centrálne aj periférne a1-adrenoreceptory. Adrenoblokátory, ako je chlórpromazín a chlórprotixén, majú výrazný sedatívny účinok. Okrem toho môže blokujúci účinok týchto liekov spôsobiť neurovegetatívne vedľajšie účinky (arteriálna hypotenzia, tachykardia atď.), ako aj zvýšenie hypotenzného účinku adrenoblokátorov.
Práce veľkého počtu autorov poskytujú údaje o väzbovej sile (afinite) jednotlivých neuroleptík s rôznymi typmi neuroreceptorov.
Na základe ich neurochemického profilu účinku možno typické a atypické antipsychotiká, ktoré sa prevažne používajú v klinickej praxi, podmienečne rozdeliť do šiestich skupín.
Prvú skupinu tvoria selektívne blokátory D2 a D4 receptorov (sulpirid, amisudprid, haloperidol atď.) zo skupín derivátov benzamidu a butyrofenónu. V malých dávkach, najmä v dôsledku blokády presynaptických D4 receptorov, aktivujú dopaminergný prenos nervových impulzov a majú stimulačný (dezinhibičný) účinok, vo veľkých dávkach blokujú D2 receptory vo všetkých oblastiach mozgu, čo sa klinicky prejavuje výrazným antipsychotickým účinkom, ako aj extrapyramídovými a endokrinnými (v dôsledku prolaktinémie) vedľajšími účinkami.
Druhá skupina zahŕňa vysoko aktívne blokátory D2-receptorov, ako aj lieky, ktoré slabo alebo stredne blokujú 5-HT2a- a 5-HT1a-receptory (flupentixol, flufenazín, zuklopentixol atď.), teda najmä piperazínové deriváty fenotiazínu alebo tioxanténov s ich stereochemickou štruktúrou blízkymi. Podobne ako lieky prvej skupiny, aj tieto neuroleptiká majú v prvom rade výrazný antipsychotický (incúzny) účinok a spôsobujú aj extrapyramídové účinky a prolaktinémiu. V malých dávkach majú mierne aktivačný (psychostimulačný) účinok.
Tretiu skupinu tvoria polyvalentné sedatívne neuroleptiká, ktoré blokujú väčšinu neuroreceptorov nediferencovaným spôsobom. Tieto lieky majú jasne vyjadrený blokujúci účinok na dopamínové receptory a tiež spôsobujú silné adrenolytické a cholinolytické účinky. Patria sem väčšina sedatívnych neuroleptík, predovšetkým alifatické a piperidínové deriváty fenotiazínu, ako aj tioxantény, ktoré sú im blízke stereochemickou štruktúrou (chlórpromazín, levomepromazín, chlórprotixén atď.). Spektrum psychotropnej aktivity týchto liekov dominuje predovšetkým výrazný primárny sedatívny účinok, ktorý sa vyvíja bez ohľadu na použitú dávku, a mierny antipsychotický účinok. Okrem toho, vďaka svojmu výraznému anticholinergnému účinku, lieky tejto skupiny spôsobujú slabé alebo mierne extrapyramídové a neuroendokrinné vedľajšie účinky, ale často vedú k rozvoju ortostatickej hypotenzie a iných autonómnych reakcií v dôsledku výraznej blokády a1-adrenergných receptorov.
Štvrtá skupina zahŕňa neuroleptiká, ktoré blokujú D2- a 5-HT2a-receptory vyváženým spôsobom, t. j. v rovnakej miere (tie druhé v o niečo väčšej miere) a a1-adrenoreceptory v miernej miere. Do tejto skupiny patria zástupcovia novej generácie atypických antipsychotík (risperidón, ziprasidón, sertindol), ktoré majú odlišné chemické štruktúry. Neurochemický mechanizmus účinku určuje ich selektívny vplyv predovšetkým na mezolimbické a mezokortikálne oblasti mozgu. Spolu s výrazným antipsychotickým účinkom, absenciou alebo slabou expresiou extrapyramídových vedľajších účinkov (pri použití terapeutických dávok), slabou alebo miernou prolaktinémiou a miernymi adrenolytickými vlastnosťami (hypotenzívne reakcie) je táto skupina neuroleptík schopná korigovať negatívne symptómy nepriamou stimuláciou dopaminergného prenosu v mozgovej kôre.
Piatu skupinu tvoria polyvalentné atypické antipsychotiká tricyklického dibenzodiazepínu alebo podobnej štruktúry (klozapín, olanzapín a kvetiapín). Rovnako ako lieky tretej skupiny blokujú väčšinu neuroreceptorov nediferencovaným spôsobom. Receptory 5-HT2a sú však blokované silnejšie ako receptory D2 a D4, najmä tie, ktoré sa nachádzajú v nigrostriatálnej oblasti. To určuje skutočnú absenciu alebo slabý extrapyramídový účinok a absenciu neuroendokrinných vedľajších účinkov spojených so zvýšenou produkciou prolaktínu s výrazným antipsychotickým účinkom a schopnosťou znižovať závažnosť negatívnych symptómov. Okrem toho majú všetky lieky tejto skupiny výrazné adrenolytické a antihistaminické vlastnosti, čo určuje sedatívne a hypotenzívne účinky. Klozapín a olanzapín majú tiež pomerne výrazný blokujúci účinok na muskarínové receptory a vedú k rozvoju cholinolytických vedľajších účinkov.
Schopnosť blokovať postsynaptické dopaminergné receptory s kompenzačným zvýšením syntézy a metabolizmu dopamínu je teda jedinou spoločnou biochemickou vlastnosťou všetkých neuroleptík zaradených do týchto skupín.
Šiesta skupina zahŕňa jediné atypické antipsychotikum, aripiprazol, ktoré sa na domácom psychofarmakologickom trhu objavilo relatívne nedávno. Tento liek je čiastočným agonistom D2-dopamínových receptorov a pôsobí ako funkčný antagonista v hyperdopaminergickom stave a ako funkčný agonista v hypodopaminergickom profile. Takýto jedinečný receptorový profil aripiprazolu umožňuje znížiť riziko extrapyramídových porúch a hyperprolaktinémie pri jeho užívaní. Okrem toho aripiprazol pôsobí ako čiastočný agonista 5-HT1a receptorov a zároveň je antagonistom 5-HT2a receptorov. Predpokladá sa, že takáto interakcia s receptormi vedie k všeobecne vyváženému fungovaniu serotonínového a dopamínového systému, takže mechanizmus účinku aripiprazolu možno označiť ako stabilizáciu dopamín-serotonínového systému.
Súčasná úroveň poznatkov o neurochemických mechanizmoch účinku neuroleptík nám teda umožňuje navrhnúť novú, patogeneticky podloženejšiu farmakodynamickú klasifikáciu tejto skupiny psychotropných liekov. Použitie tejto klasifikácie nám umožňuje do značnej miery predpovedať spektrum psychotropnej aktivity, tolerancie a pravdepodobných liekových interakcií konkrétneho lieku. Inými slovami, vlastnosti neurochemickej aktivity lieku do značnej miery určujú vlastnosti jeho klinickej aktivity, ktoré by sa mali použiť pri výbere konkrétneho antipsychotika pre konkrétneho pacienta.
Účinnosť globálneho antipsychotického účinku akéhokoľvek neuroleptika sa odhaduje pomocou tzv. chlórpromazínového ekvivalentu, ktorý sa berie ako 1. Napríklad chlórpromazínový ekvivalent haloperidolu = 50. To znamená, že antipsychotická účinnosť 1 mg haloperidolu je porovnateľná s 50 mg chlórpromazínu. Na základe tohto ukazovateľa bola vyvinutá klasifikácia, ktorá umožňuje rozdelenie neuroleptík s vysokou (chlórpromazínový ekvivalent > 10,0), strednou (chlórpromazínový ekvivalent = 1,0-10,0) a nízkou (chlórpromazínový ekvivalent = 1,0) antipsychotickou aktivitou, nazývanou patentita. Typické neuroleptiká (psychotiká prvej generácie) sa v klinickej psychofarmakoterapii široko používajú už takmer pol storočia. Spektrum ich terapeutickej aktivity zahŕňa:
- globálny antipsychotický účinok vo forme schopnosti rovnomerne a diferencovane znižovať rôzne prejavy psychózy:
- primárny sedatívny (inhibičný) účinok - schopnosť liekov rýchlo zmierniť psychomotorickú agitáciu;
- selektívny, selektívny antipsychotický účinok, prejavujúci sa schopnosťou ovplyvniť jednotlivé symptómy: delírium, halucinácie, dezinhibícia pudov atď.;
- aktivačný (dezinhibičný, dezinhibičný, antiautistický) neurotropný účinok, prejavujúci sa rozvojom extrapyramídových symptómov;
- somatotropný účinok vo forme vývoja neuroendokrinných a vegetatívnych vedľajších účinkov;
- depresívny účinok, prejavujúci sa schopnosťou niektorých antipsychotík vyvolať depresívne symptómy.
Účinnosť antipsychotík prvej generácie pri liečbe nielen psychotických porúch, ale aj porúch v rámci hraničnej psychiatrie bola mnohokrát preukázaná a je nespochybniteľná. Preto sa napriek vysokej frekvencii vedľajších účinkov liečby pri ich predpisovaní naďalej používajú v lekárskej praxi.
Atypické antipsychotiká
Moderné odporúčania obsahujú údaje o výhodách používania antipsychotík druhej generácie vo farmakoterapii. Pojem „atypický“ (synonymum – antipsychotiká druhej generácie) je podmienený a používa sa hlavne pre pohodlie označenia novej generácie. V porovnaní s tradičnými neuroleptikami sú lieky tejto skupiny účinnejšie pri korekcii negatívnych, afektívnych a kognitívnych porúch, čo je spojené s lepšou znášanlivosťou a nižším rizikom extrapyramídových symptómov. Rozdiely v povahe terapeutického účinku jedného alebo druhého lieku zo série atypických antipsychotík sa vysvetľujú, rovnako ako v skupine typických neuroleptík, jeho individuálnym profilom farmakologického účinku.
Pre objasnenie možností psychofarmakoterapie atypickými antipsychotikami je vhodné zamerať sa na lieky tejto skupiny registrované v Rusku.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Klozapín (dibenzodiazepín)
Zakladateľ skupiny atypických antipsychotík. Mechanizmus účinku klozapínu sa vyznačuje miernou blokádou D2 receptorov so súčasným vysokým antagonizmom voči 5-HT2a receptorom, a1, a2-adrenergným a H1-histamínovým receptorom. Osvedčil sa ako účinné antipsychotikum v prípadoch rezistencie na iné antipsychotiká (liek rezervnej skupiny) a je tiež indikovaný na liečbu chronickej mánie, psychotickej agitácie, agresie. V domácej praxi sa klozapín často predpisuje na dosiahnutie sedácie a ako hypnotikum u psychotických pacientov. Treba si uvedomiť, že takéto použitie klozapínu nezodpovedá jeho hlavnému profilu indikácií na použitie v terapii. Pravdepodobne by sa mal prehodnotiť postoj k tomuto antipsychotiku ako k lieku druhoradého významu, pretože dnes je to jediný liek s preukázanou účinnosťou u rezistentných pacientov.
Klozapín, na rozdiel od typických neuroleptík, nespôsobuje závažné extrapyramídové poruchy kvôli spomínanej nízkej afinite k O2 receptorom. Ukázalo sa tiež, že sa môže použiť na liečbu neskorej dystónie a ťažkej akatízie. Vzhľadom na nízke riziko vzniku NMS možno klozapín považovať za liek voľby u pacientov, ktorí už predtým trpeli touto komplikáciou.
Počas liečby klozapínom sa však môže vyvinúť množstvo závažných vedľajších účinkov. Najnebezpečnejším z nich (aj pri predpisovaní malých dávok) je agranulocytóza, ktorá sa vyskytuje u 0,5 – 1,0 % pacientov. Medzi ďalšie dôležité vedľajšie účinky, ktoré sa môžu vyskytnúť pri užívaní lieku, patrí ospalosť, hypersalivácia a priberanie na váhe, ktoré je často už v čase predpísania klozapínu pod vplyvom predchádzajúcej antipsychotickej liečby zvýšená. Pozornosť je potrebné venovať aj možnosti vzniku tachykardie, arteriálnej hypotenzie a epileptických záchvatov počas jeho užívania. Pravdepodobnosť vzniku záchvatov závisí od dávky. Ich riziko sa výrazne zvyšuje, ak dávka klozapínu prekročí 600 mg/deň. Výskyt záchvatov nie je kontraindikáciou pre ďalšie užívanie lieku, ale vyžaduje si zníženie dávky na polovicu a predpísanie antikonvulzív, ako je kyselina valproová. Prevencia vedľajších účinkov liečby klozapínom zahŕňa starostlivé sledovanie počtu bielych krviniek, ako aj EKG a endokrinných parametrov.
Predávkovanie klozapínom môže spôsobiť útlm vedomia až po rozvoj kómy, ako aj príznaky spojené s cholinolytickým účinkom (tachykardia, delírium), epileptické záchvaty, respiračnú depresiu, extrapyramídové syndrómy. Pri užití dávky presahujúcej 2500 mg lieku môže dôjsť k fatálnemu koncu.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidón
Derivát benzizoxazolu s vysokou afinitou k serotonínovým a dopamínovým Dj receptorom s prevažujúcim účinkom na serotonínový systém. Liek má širokú škálu indikácií na použitie vrátane úľavy od exacerbácií, liečby relapsu, terapie prvej psychotickej epizódy a korekcie negatívnych symptómov schizofrénie. Ukázalo sa, že liek zlepšuje kognitívne funkcie u pacientov so schizofréniou. Boli získané predbežné údaje, že risperidón tiež znižuje komorbidné afektívne symptómy u pacientov so schizofréniou a môže byť liekom voľby pri liečbe bipolárnych afektívnych porúch.
Vedľajšie účinky liečby risperidónom, najmä extrapyramídové poruchy, sú závislé od dávky a vyskytujú sa častejšie pri dávkach presahujúcich 6 mg/deň. Medzi ďalšie vedľajšie účinky patrí nevoľnosť, vracanie, úzkosť, ospalosť a zvýšené hladiny prolaktínu v sére. Dlhodobé užívanie risperidónu môže viesť k priberaniu na váhe a rozvoju diabetu mellitus 2. typu, ale s nižšou pravdepodobnosťou v porovnaní s klozapínom, olanzapínom.
Predávkovanie môže spôsobiť ospalosť, epileptické záchvaty, predĺženie QT intervalu a rozšírenie QRS komplexu a arteriálnu hypotenziu. Boli popísané prípady fatálnych následkov v dôsledku predávkovania risperidónom.
Nepochybnou výhodou lieku je dostupnosť tekutých a rýchlo sa rozpúšťajúcich (sublingválnych) foriem, ktorých použitie urýchľuje vstup lieku do tela pacienta a uľahčuje kontrolu nad jeho príjmom. Existuje aj predĺžená forma lieku - prášok na prípravu suspenzie na intramuskulárne podanie (consta-risperidón v mikrosférach). Odporúča sa na udržiavaciu liečbu pacientov so schizofréniou, najmä u pacientov so slabou spoluprácou. Je potrebné vziať do úvahy skutočnosť, že liek potrebuje približne tri týždne na vstup do krvného obehu, preto pri začatí liečby consta-risperidónom musí pacient dodatočne užívať perorálnu formu risperidónu najmenej 3 týždne po prvej injekcii.
Olanzapín
Z hľadiska farmakologického účinku je blízky klozapínu, pretože má pleiomorfný receptorový profil s významnou afinitou k serotonínovým, muskarínovým, a1-adrenergným a histamínovým receptorom. Terapeutická aktivita olanzapínu má podobné vlastnosti ako účinnosť klozapínu a risperidónu, pokiaľ ide o vplyv na pozitívne, negatívne a depresívne symptómy schizofrénie. Zároveň sa získali údaje o vyššej účinnosti olanzapínu v porovnaní s inými atypickými antipsychotikami u pacientov s prvou psychotickou epizódou a pri korekcii ukazovateľov kognitívnych funkcií. Treba vziať do úvahy, že na začiatku liečby tabletovou formou lieku sa môže prejaviť rýchly disinhibičný účinok so zvýšenou psychomotorickou agitáciou a úzkosťou. Preto je pri liečbe záchvatov sprevádzaných ťažkou psychomotorickou agitáciou indikované použitie injekčnej formy lieku.
Olanzapín zriedkavo spôsobuje extrapyramídové poruchy alebo tardívnu dyskinézu a najčastejšie vedľajšie účinky pri jeho užívaní sú metabolické poruchy a priberanie na váhe. Zistilo sa, že pacienti užívajúci olanzapín pomerne často pociťujú zvýšené hladiny cholesterolu, plazmatických lipidov a predispozíciu k diabetes mellitus 2. typu, ale tieto účinky boli rovnako časté u pacientov užívajúcich olanzapín aj klozapín. Zároveň sa získali údaje, ktoré ukazujú, že priberanie na váhe koreluje s pozitívnou odpoveďou na olanzapín (t. j. slúži ako dôležitý prognostický ukazovateľ liečby) a do obezity sa vyvinie iba u 20 – 30 % pacientov, ktorí počas liečby pribrali na váhe.
Predávkovanie môže spôsobiť sedáciu, toxické anticholinergné účinky, epileptické záchvaty a arteriálnu hypotenziu. V súčasnosti neexistujú presvedčivé údaje na posúdenie rizika úmrtia v dôsledku predávkovania.
Kvetiapín
Je klasifikovaný ako dibenzotiazepínová zlúčenina. Jeho receptorový profil je do značnej miery podobný profilu klozapínu. Väzbová hladina kvetiapínu na D2 receptory je nízka (menej ako 50 %) a krátkodobá, a to aj pri použití vysokých dávok. Liek je účinný pri liečbe pozitívnych, negatívnych a všeobecných symptómov schizofrénie. Existujú dôkazy o jeho úspešnom použití v prípadoch vysokej rezistencie na liečbu aj na zlepšenie kognitívnych funkcií pacientov, čo ho oprávňuje odporúčať ako antipsychotikum prvej voľby na udržiavaciu liečbu schizofrénie. Kvetiapín má napokon mierny antidepresívny, aktivačný účinok. Preto je indikovaný pri liečbe depresívne-bludových záchvatov a porúch senesto-hypochondrického kruhu.
Zistená vysoká tymotropná aktivita kvetiapínu vysvetľuje skutočnosť, že je registrovaný ako prostriedok na úľavu a sekundárnu prevenciu depresívnych porúch. Na liečbu manických epizód v rámci bipolárnych porúch typu I a II sa kvetiapín používa ako doplnkový prostriedok. Absencia injekčných foriem do istej miery obmedzuje jeho použitie u pacientov s agitáciou a agresívnym správaním.
Kvetiapín je dobre tolerovaný, prakticky nespôsobuje extrapyramídové syndrómy, s výnimkou prípadov, keď sa používajú maximálne dávky. Kvetiapín nespôsobuje hyperprolaktinémiu, menej často ako olanzapín a klozapín vedie k priberaniu na váhe a zhoršenej glukózovej tolerancii.
Ziprasidón
Má jedinečný profil receptorovej aktivity. Ako silný antagonista 5HT2a receptorov a D2 receptorov je tiež aktívnym inhibítorom spätného vychytávania serotonínu a norepinefrínu. Klinické štúdie preukázali významnú prevahu ziprasidónu v jeho účinku na psychotické symptómy a prejavy agresie v porovnaní s haloperidolom. Existujú tiež údaje o pozitívnom účinku ziprasidónu na kognitívne funkcie pacientov so schizofréniou, ako aj na komorbidné afektívne symptómy, ukazovatele sociálneho fungovania. Ziprasidón je zvyčajne dobre tolerovaný a veľmi zriedkavo spôsobuje extrapyramídové syndrómy, priberanie na váhe a metabolické poruchy. Častejšie dochádza k predĺženiu QT intervalu nad 460 ms, preto sa odporúča, aby pacienti užívajúci tento liek podstúpili EKG vyšetrenie pred predpísaním lieku a kontrolné monitorovanie počas liečby. Osobitná pozornosť by sa mala venovať súbežnej liečbe (užívanie antiarytmík), ktorá môže zhoršiť predĺženie QT intervalu a viesť k rozvoju srdcovej arytmie, fibrilácie komôr.
Sertindol
Patrí medzi deriváty fenylindolu. Má vysoký funkčný antagonizmus voči D2-, serotonínovým (najmä 5-HT2a-receptorom) a a1-adrenergným receptorom. Podľa elektroneurochemických štúdií sertindol selektívne inhibuje dopamínové receptory vo ventrálnej segmentálnej oblasti. Takáto selektivita s najväčšou pravdepodobnosťou zabezpečuje nízke riziko extrapyramídových syndrómov a hyperprolaktinémie pri užívaní lieku. Výsledky porovnávacích štúdií ukázali, že sertindol je z hľadiska antipsychotickej aktivity porovnateľný s haloperidolom. Liek má výrazný dezinhibičný účinok u pacientov s negatívnymi a depresívnymi príznakmi, ktorý je lepší ako podobný účinok rispoleptu. Existujú tiež dôkazy potvrdzujúce účinnosť sertindolu pri korekcii kognitívnych porúch u pacientov so schizofréniou. Sertindol je pacientmi vo všeobecnosti dobre tolerovaný, zriedkavo spôsobuje sedáciu, a preto sa odporúča ako náhradný liek, ak sa počas liečby inými modernými antipsychotikami vyskytnú vedľajšie účinky.
Medzi závažné vedľajšie účinky patrí schopnosť lieku predĺžiť QT interval, čo môže viesť k srdcovej arytmii. Pri analýze postmarketingových štúdií sa ukázalo, že srdcový profil sertindolu sa nelíši od profilu iných antipsychotík novej generácie.
Aripiprazol
Má antipsychotickú aktivitu porovnateľnú s inými atypickými látkami, ale má väčší vplyv na parametre kognitívnych funkcií pacientov so schizofréniou. Vyššie uvedený jedinečný farmakologický účinok lieku - čiastočného agonistu D2 receptorov - umožňuje znížiť riziko extrapyramídových syndrómov a hyperprolaktinémie pri jeho užívaní.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulprid
Patrí do triedy substituovaných benzamidov. Liek sa selektívne viaže na podtypy dopaminergných receptorov D2 a D3, nemá afinitu k podtypom D1, D4 a D5, ako aj k serotonínovým, H1-histamínovým, a1-adrenergným a cholinergným receptorom. Pri použití vo vysokých dávkach blokuje postsynaptické D2 receptory. V nízkych dávkach sa jeho disinhibičný účinok prejavuje blokádou presynaptických D2 a D3 receptorov, vďaka čomu je jeho použitie účinné aj pri liečbe negatívnych symptómov, hoci nie je kombinovaným antagonistom D2 receptorov a serotonínových receptorov. Výsledky viacerých štúdií naznačujú výraznú antipsychotickú aktivitu lieku pri použití vo vysokých dávkach, ktorá je lepšia ako tradičné lieky.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Vedľajšie účinky antipsychotickej liečby
V tabuľke sú uvedené hlavné vedľajšie účinky atypickej antipsychotickej liečby.
Príprava |
Extrapyramídové |
Porucha vedenia na EKG |
Metabolické poruchy (priberanie na váhe, zvýšené hladiny glukózy, cholesterolu, triglyceridov v krvi) |
||
Klozapín |
. |
++ |
++ |
++- |
|
Risperidón |
++ |
+/- |
++ |
+/- |
|
Olanzapín |
+ |
+/- |
+++ |
++ |
+++ |
Kvetiapín |
+/- |
+ |
+/- |
--- |
|
Ziprasidón |
+ |
++ |
+/- |
+/- |
+/- |
Sertindol |
++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulprid |
++ |
+/- |
|||
Poznámka. Závažnosť vedľajších účinkov: "+++" - vysoká; "++" - priemerná; "+" - nízka; "+/-" - otázne; "-" - chýbajúce.
Extrapyramídové syndrómy
Jednou z hlavných vlastností atypických antipsychotík, na rozdiel od tradičných, je ich nízka schopnosť vyvolávať extrapyramídové syndrómy, čo sa stalo prelomom v udržiavacej farmakoterapii schizofrénie. Ako však vyplýva z údajov v tabuľke, pri používaní jednotlivých liekov tejto série (risperidón, amisulprid) sa môžu vyskytnúť takéto príznaky, čo si vyžaduje osobitnú pozornosť pri ich predpisovaní.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Abnormality EKG
Možnosť vzniku vedľajších účinkov na srdce je vážnym problémom pri používaní niektorých moderných antipsychotík v terapii. V týchto prípadoch hovoríme o predĺžení QT intervalu, čo môže viesť k rozvoju arytmie. Poruchy vedenia, predovšetkým predĺženie QT intervalu, sa najčastejšie pozorujú počas liečby klozapínom, sertindolom, ziprasidónom. Súbežná patológia vo forme bradykardie, atrioventrikulárneho bloku, hypotyreózy môže prispieť k výskytu tejto komplikácie počas liečby vyššie uvedenými liekmi. V súčasnosti sa u pacientov, ktorí dostávajú udržiavaciu liečbu atypickými antipsychotikami, odporúča monitorovanie EKG približne raz za 3 mesiace.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Endokrinné poruchy
V súčasnosti najväčšie obavy vyvoláva schopnosť atypických antipsychotík spôsobiť priberanie na váhe. Zvýšená telesná hmotnosť, hladiny glukózy a triglyceridov v krvi môžu viesť k metabolickým poruchám a rozvoju cukrovky 2. typu. Počas liečby klozapínom a olanzapínom je potrebná mimoriadna opatrnosť a týždenné monitorovanie biochemických parametrov. Podľa J. Geddesa a kol. (2000), PB Jonesa, PF Buckleyho (2006) by sa malo považovať za vhodné dôkladné vyšetrenie pacientov pred predpísaním konkrétneho antipsychotika modernej generácie, pretože je známe, že metabolické poruchy sa častejšie vyskytujú u pacientov, ktorí mali pred začiatkom liečby dedičnú predispozíciu, nadváhu, poruchy lipidového spektra a hyperglykémiu. Monitorovací algoritmus navrhnutý PB Jonesom a PF Buckleym (2006) obsahuje niekoľko bodov.
- Zber anamnézy a rodinných faktorov týkajúcich sa rizika metabolických porúch.
- Zaznamenanie indexu telesnej hmotnosti, EKG, krvného tlaku a pulzu pred začiatkom liečby.
- Zber laboratórnych údajov (glukóza, lipidový profil, cholesterol) pred začiatkom liečby.
- Pravidelné sledovanie indexu telesnej hmotnosti a vitálnych funkcií počas liečby.
- Monitorovanie laboratórnych údajov počas liečby.
Výskyt hyperprolaktinémie počas antipsychotickej liečby je spôsobený centrálnou blokádou dopamínových receptorov v hypotalame, čo vedie k uvoľňovaniu prolaktínu z prednej hypofýzy. Hyperprolaktinémia sa najčastejšie vyskytuje pri liečbe olanzapínom, risperidónom a amisulpridom.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulocytóza
Ďalšia závažná komplikácia antipsychotickej liečby. Môže sa pozorovať počas liečby klozapínom a olanzapínom. Podľa J. Geddesa a kol. (2000) bola diagnostikovaná počas prvých 3 mesiacov u 1 – 2 % pacientov užívajúcich tieto lieky. V tejto súvislosti sa pacientom užívajúcim tieto lieky počas prvých 18 týždňov liečby odporúčajú týždenné krvné testy a následne mesačné monitorovanie. Ukázalo sa, že po znížení dávky vyššie uvedených neuroleptík sa klinický krvný test vráti do normálu. Zároveň treba uznať, že doteraz neexistuje jasná stratégia pre pacientov, u ktorých sa vyskytujú vyššie uvedené vedľajšie účinky spojené s metabolickými poruchami. Najčastejšie sa jedno atypické antipsychotikum nahrádza iným. Ďalším sľubným smerom je predpisovanie špeciálnej korekčnej terapie, najmä použitie bromokriptínu na korekciu hyperprolaktinémie. Ideálna situácia je taká, v ktorej sa starostlivosť o pacienta s takýmito poruchami vykonáva s pravidelným zapojením internistov, najmä endokrinológov, kardiológov a ďalších špecialistov.
Na záver treba poznamenať, že ak sa dodržiavajú dané algoritmy pre predpisovanie a monitorovanie nielen psychického, ale aj fyzického stavu pacientov, je užívanie liekov druhej generácie bezpečnejšie ako typických neuroleptík.
V súčasnosti je vo vývoji množstvo ďalších antipsychotík. Lieky novej generácie budú mať pravdepodobne odlišný mechanizmus účinku (napríklad GABAergný profil) a budú schopné ovplyvniť rôzne prejavy schizofrénie vrátane samotných deficitných porúch.
Pozor!
Na zjednodušenie vnímania informácií boli tieto pokyny na používanie lieku "Neuroleptiká alebo antipsychotiká " preložené a predložené v špeciálnom formulári na základe oficiálnych pokynov na lekárske použitie lieku. Pred použitím si prečítajte anotáciu, ktorá prišla priamo k lieku.
Popis je poskytovaný na informačné účely a nie je návodom na seba-liečenie. Potreba tohto liečiva, účel liečebného režimu, spôsobov a dávky liečiva určuje výlučne ošetrujúci lekár. Samoliečenie je pre vaše zdravie nebezpečné.

